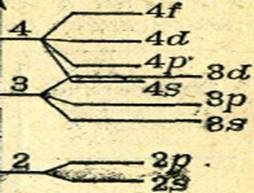
calcule cuantice arată că, în atomii multi-electron un nivel de energie variază electroni, electronii umple orbitali atomici de diferite tipuri și au diferite de energie. Fiecare nivel de energie, cu excepția primei, este împărțit într-un număr de subnivele de energie, cât de multe tipuri de orbitali include acest nivel. Al doilea nivel de energie este împărțit în două subnivele (2s și 2p subnivele), al treilea nivel energetic - în trei subnivele (3s, 3d-3R- și subniveluri) etc. despicarea al doilea, al treilea și al patrulea nivelurile de energie prezentate în Fig ... 9.
Fiecare substrat s-conține o s-AO, fiecare substrat p are trei p-AO, fiecare d-substrat are cinci d-AO și fiecare substrat f are șapte f-AO.
Nivelul energetic se caracterizează prin numărul principal quantum n. Pentru toate elementele cunoscute, valorile lui n variază de la 1 la 7. Electronii dintr-un atom multielectron în starea de sol (ne-excitate) ocupă nivelele de energie de la primul la cel de-al șaptelea.
Energia subterană este caracterizată de numărul cuantic orbital l. Pentru fiecare nivel (n = const), numărul cuantum l ia toate valorile întregi de la 0 la (n - 1), de exemplu, pentru n = 3, valorile l sunt 0, 1 și 2. Numărul orbital cuantic determină forma geometrică a orbitalilor.
Regularitatea umplerii cochiliilor electronice ale atomilor este determinată de principiul interzicerii, stabilit în 1925 de fizicianul elvețian Pauli (principiul interzicerii Pauli): doi electroni în aceleași stări nu pot exista simultan într-un atom.
Doi electroni care ocupă diferite nivele de energie și sublevels într-un atom sunt în diferite stări mecanice cuantice. Electronii diferență de ocupație diferite orbitali atomici un subnivel (n = const), cu excepția s-subnivelul, caracterizată prin numărul magnetic ml cuantic. Acest număr se numește magnetic, deoarece caracterizează comportamentul electronilor într-un câmp magnetic extern. Dacă valoarea l determină forma geometrică a orbitali atomice subnivel, valoarea numărului cuantic stabilește dispunerea spațială reciprocă a acestor orbitali.
Numărul cuantic magnetic din cadrul sublevelului dat are toate valorile întregi de la + l la -l, inclusiv zero. Pentru s-sublevel ml = 0.
Pentru substratul p, ml poate lua trei valori +1, 0, -1.
Astfel, fiecare orbital atomic este determinat în mod unic de trei numere cuantice.
Combinația a trei numere cuantice care caracterizează o anumită orbitală atomică este aleasă din ansamblul tuturor valorilor posibile ale numerelor cuantice.
Având în vedere faptul că fiecare orbital poate fi umplut maxim cu doi electroni, numărul de electroni care pot fi localizați la fiecare nivel de energie și subsol este de două ori mai mare decât numărul de orbite la un anumit nivel sau sub nivelul inferior. Deoarece electronii dintr-un orbital atomic au aceleași numere cuantice n, l și ml. apoi pentru a distinge cei doi electroni - pe un singur orbital, al patrulea, numărul cuantic spin este utilizat. care este determinată de spinul electronilor. În conformitate cu principiul Pauli, se poate argumenta că fiecare electron dintr-un atom este caracterizat în mod unic de propriul set de patru numere cuantice.
Populația de electroni a nivelurilor de energie, subsoluri și atomice
Orbitalii respectă următoarea regulă: într-un atom neexectat, toți electronii au cea mai mică energie.
Umplerea orbital atomic în termen de o subnivel de energie are loc în conformitate cu o normă formulată fizician german Hund F. (1927) (regula Hund lui): orbitali atomici aparținând aceluiași subnivelul, fiecare prim umplut cu un electron, iar apoi umplerea a doua este electronii .
Trimiteți-le prietenilor: