
Țară. Franța
Timp de invenție. 1859
Descoperirea efectului de acumulare este una dintre cele mai importante și importante invenții din domeniul ingineriei electrice. Foarte des, a existat nevoia de a furniza electricitate dispozitivelor sau mecanismelor într-un loc în care nu există surse de energie.
De mult timp, pentru aceste scopuri a fost folosită o baterie galvanică, dar a fost o sursă de curent slabă, costisitoare și extrem de greoaie. Crearea unei baterii electrice a simplificat mult această sarcină.
Chiar și în 1802, Ritter a descoperit că două plăci de cupru în acid și muiată conectat la bateria galvanic, încărcată și apoi poate fi utilizat ca o sursă de curent constant pentru o perioadă scurtă de timp. Acest fenomen a fost ulterior studiat de mulți alți oameni de știință.
În 1854, medicul militar german Wilhelm Zinsteden a observat următorul efect: când curentul este trecut

Dacă un astfel de element și apoi închis circuitul, încetând care trece prin el de la sursa de curent constant, curent constant care apare în acesta, care este detectată atât timp cât întregul dioxidul de plumb nu se dizolvă în acid. Astfel, Zinsteden a venit aproape de a crea o baterie, dar el nu a tras concluzii practice din observația sa.
Doar cinci ani mai târziu, în 1859, inginerul francez Gaston Plante (Gaston Plante) a făcut din greșeală aceeași descoperire și a construit o baterie de plumb pentru prima dată în istorie. Acesta a fost începutul tehnologiei bateriei.
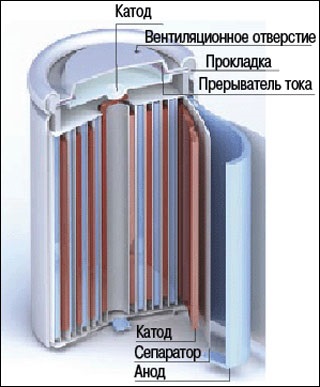
Bateria Plante a constat din două plăci de plumb identice, înfășurate pe un cilindru de lemn. Prieten de la

Ce explică procesele care au loc în baterie? Ca și în celulă, curentul electric aici - o consecință a unei reacții chimice care pot să apară de multe ori în ambele direcții. Imaginați-vă că începem să încărcați bateria descărcată prin atașarea acesteia la o sursă de curent continuu. De obicei, nu este încărcată încă masa plăcii de plumb pozitiv cuprinde, pe rămășițe ale ciclului anterior - plumb PbO oxid și PbSO4 sulfat de plumb, iar negativ - doar plumb PbO oxid.
Sub acțiunea electrolitului curentului electric - acidulată apă - începe să se descompună: la electrodul pozitiv, oxigen, care oxidează imediat oxid de plumb și sulfat de plumb la peroxid PbO2 (în care SO4 acidul rest intră în soluție) și hidrogen eliberată pe placa negativă. Acesta din urmă combină cu oxigenul oxidului, formând plumb metalic și apă. Apoi, gazul începe să se acumuleze în porii plăcii de plumb.
Dacă o baterie încărcată este conectată la circuit, curentul a trecut prin baterie în timpul încărcării,

Acidul sulfuric din lichidul se deplasează la electrodul pozitiv și formele de sulfat de plumb din nou, în timp ce hidrogenul și plumbul pe placa negativa sunt oxidați, primul - apa, al doilea - în oxid de plumb. Într-o formă oarecum simplificată (fără procese simultane) descărcarea reacția chimică este de forma: PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O.
Când fenomenele de încărcare merg în direcția opusă. Această reacție, însoțită de eliberarea curentului electric, continuă până când cantitatea de oxid de plumb de pe ambele plăci este echilibrată. Aceeași reacție are loc într-o baterie deschisă, dar mult mai lentă. În timpul încărcării (datorită separării reziduului acid în soluție), greutatea specifică a lichidului din acumulator crește, iar atunci când este descărcată, scade (de la
atunci când este evacuat, acidul sulfuric se combină cu oxid de plumb și formează sulfat de plumb pe electrozii). În timpul descărcării, energia reacțiilor chimice devine electrică, iar în timpul încărcării - invers.
Un dezavantaj semnificativ al bateriei centralei a fost capacitatea mică - a fost descărcată prea repede. Curând, Plante a observat că capacitatea poate fi mărită prin pregătirea specială a suprafeței plăcilor de plumb, care ar trebui să fie cât mai poroasă posibil. Pentru a realiza acest lucru, instalația a descărcat bateria încărcată și apoi a trecut din nou curentul prin ea, dar în direcția opusă. Acest proces de formare a placilor a fost repetat de mai multe ori în aproximativ 500 de ore și a fost intenționat să crească un strat de oxid de plumb pe ambele plăci.
Până la inventarea mașinii dinamometrice, bateriile nu aveau un interes deosebit pentru inginerii electrici, dar când a devenit posibilă încărcarea rapidă și ușoară a acestora cu un generator, bateriile au cea mai mare distribuție. În 1882, Camille a îmbunătățit foarte mult tehnica de fabricare a plăcuțelor bateriei.

Că masa de oxizi formată pe plăci nu a căzut, au fost acoperite cu o cârpă. Bateria Handicap nu este încărcată doar mai repede decât bateria Plante, dar are și o capacitate semnificativ mai mare și ar putea da un curent foarte puternic. Acesta a constat din plăci de plumb paralele, plasate aproape una de alta și conectate printr-una, astfel încât fiecare electrod de un semn plasat între doi electrozi

Invenția din Fora a atras imediat atenția inginerilor electrici. Bancherul german Volkmar, care a preluat producția bateriilor Fora, le-a îmbunătățit imediat. În bateriile vechi, un strat de oxizi, așa cum sa menționat deja, nu a aderat bine la grătar și ar putea cădea cu ușurință atunci când a fost scuturat.
Acesta a fost un defect grav în proiectare, deoarece interferează cu utilizarea bateriilor în transport. Pentru a corecta problema, Volkmar a sugerat că plăcile de plumb nu ar trebui să fie continue, ci sub formă de grătare, ale căror găuri au fost umplute cu plumb spongios. Pe astfel de grătare, masa activă nu mai este pur și simplu aderentă la plumb, ci este ținută ferm în celule.
La începutul secolului al XX-lea, îmbunătățirea bateriei a fost preluată de Edison, care a vrut să facă mai mult

Ca de obicei, Edison a început să lucreze pe o scară largă: a creat un laborator special, cu un mare număr de chimiști și ia instruit să studieze toate aceste domenii. În esență, a fost vorba despre crearea unui tip complet de acumulator, în care electrolitul a fost un alcalin, iar un electrod negativ a fost de fier măcinat cu unele impurități. Pentru o lungă perioadă de timp, nu a fost posibilă selectarea materialului pentru electrodul pozitiv. Deoarece procesele chimice din bateria alcalină erau foarte complexe și nu au fost pe deplin înțelese, trebuia să se păcălească literalmente. În modelele experimentale, electrodul pozitiv a fost făcut din cărbune, porii căruia s-au umplut cu diferite substanțe: multe metale și compușii lor au fost încercați, dar toate au dat un rezultat insuficient de bun.
În cele din urmă, ne-am oprit la nichel, care sa dovedit a fi cea mai potrivită. Deci, Edison a venit la bateria nichel-fier cu un electrolit sub forma de potasiu caustic. Reacția chimică care apare în cursul descărcării în

Mai multe astfel de baterii au fost construite pentru teste complete, iar cercetătorii au fost dezamăgiți - capacitatea bateriei a fost foarte mică. Edison a observat că puritatea materialului are o mare importanță pentru creșterea capacității. El a comandat un eșantion de calitate superioară a nichelului canadian, după care capacitatea bateriilor a crescut imediat de trei ori. În West Orendje a fost construită o mică fabrică pentru rafinarea (curățarea) fierului și a nichelului. Capacitatea noii baterii a fost de 2, 5 ori mai mare decât vechiul plumb. Edison a susținut că acesta este cel mai mare progres în tehnologia bateriilor de la începuturile sale.
Debugarea a fost încredințată mai multor grupuri simultan: unul a lucrat la îmbunătățirea sudării vaselor de baterii, celălalt la rafinarea fierului, al treilea a fost angajat în nichel și aditivi la acesta. Până în 1905, au fost efectuate mai mult de 10 mii de experimente suplimentare, iar în 1910 sa reintrodus în producție o baterie îmbunătățită semnificativ. În primul an, producția a fost eliberată pentru 1 milion de dolari și totul sa vândut bine. Curând, o nouă baterie portabilă a fost utilizată pe scară largă în transporturi, centrale electrice, nave mici și submarine.
Aș fi foarte recunoscător dacă împărțiți un articol în domeniul social. crearea de rețele
Articole similare
Trimiteți-le prietenilor: