CHROMĂ DE OXIZI
CHROMĂ DE OXIZI. În sistemul Cr-O (Fig.), Există oxizi de CrO, CrO2. Cr2O3, etc. OXIDI DE CHROME o. sunt comparate în Tabelul. oxid inferior CrO punctul metastabile compoziția în sistemul Cr-Cr2 O3 adjudecate pentru a topi laminare, care se extinde 2-48% at. Of O. Acest sistem este găsit, de asemenea, oxid de topire incongruent Cr3 O4. la temperaturi mai mari
1550 ° C. Are o structură spinel distorsionată.
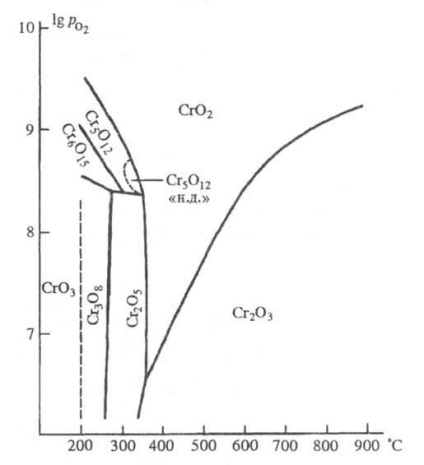
Zone de stabilitate a oxizilor de crom: - Presiunea de oxigen (Pa); "ND" - presiune scăzută.
CrO - cristale roșii sau pulbere piroforică neagră; cristalin. CrO este stabil în aer, insolubil în apă, dar se oxidează intens deasupra
100 ° C Reacționează cu HCI cu evoluția hidrogenului, cu HNO3 diluat și H2SO4 diluat nu interacționează. CrO este obținut prin descompunerea termodinamică a carbonil Cr (CO) 6. Utilizat ca adsorbant pentru curățarea hidrocarburilor din O2.
Cr (OH) 2 hidroxid maro sau galben precipită din soluții de săruri Cr (II) cu alcalii în absența oxigenului; produs de dizolvare 2,0 x 10 -20; nu este solubil în soluții de alcalii și acizi diluanți, lent solubil în concentrație. acizi; este rapid oxidat în aer.
Cr (III) oxid (sesquioxide) Cr2O3 (esoilit mineral) are o structură de tip corundum (formă). Culoarea sa variază de la verde deschis în material fin divizat până la aproape negru în cristale mari. Când se încălzește, culoarea verde se inversează în maro. Există Cr2O3 amorf. și o formă cubică metastabilă cu o structură de tip spinel (a = 0,836 nm) în culoare brună. Un tetragon este de asemenea descris. modificare (a = 0,9480 nm, c = 0,5160 nm), aparent stabilă peste 1000 ° C Cr2O3 semnificativ volatil de mai sus
1200 ° C; se evaporă congruent, cu disociere în vapori; ecuația dependenței de temperatură a presiunii de vapori lgp (mm Hg) = 10,62 - 25300 / T (1504 - 1821 K); paramagnetic, la 32 K (punctul Neel) intră într-un antiferromagnet. stare, trecerea de 0,80 kJ / mol; semiconductor, bandgap
3,4 eV; duritate pe scara Mohs 9.
PROPRIETĂȚI ALE OXIDELOR CHROME
* Incongruent. ** punct de fierbere de 3000 o C.
Cr2O3 este inactiv chimic. Nu este solubil în apă și solvenți organici, nu interacționează cu soluții de alcalii, solubilitate. numai în acizi puternici la încălzire prelungită, oxidat și trece în soluție prin acțiunea soluțiilor fierbinți ale persulfați sau clorați, și 70% NClO4. Se oxidează cu topituri KNO3 și KCI03. interacțiunea cu topiturile alcaline în aer. Când se sinterizează cu oxizi metalici sau carbonați, formează cromi (vezi Lame). Interacțiunea. cu clor în prezența carbonului la 650-850 ° C. superior
1500 ° C este redus la metal prin acțiunea H2. C, CO, Si, Al, Ca, Mg și altele asemenea.
Obțineți Cr2O3 prin descompunerea termodinamică a hidroxidului sau a cromcromatului hidratat (vezi mai jos), CrO3. (NH4) 2Cr2O7. calcinarea bicromatilor Na sau K cu cărbune, urmată de leșiere, arderea de Cr în O2. Oxidul de înaltă frecvență este recomandat a fi oxidat de un compus organocloric, de exemplu etilbenzenclrom. Utilizarea Cr2O3 pentru a produce metale. și carburi de crom, ca pigment, catalizator de sinteză organică (oxidare, cracare, hidrogenare și dehidrogenare) ca un material de lustruire, feritele componente refractare.
Un număr de hidroxizi Cr (III) sunt cunoscuți. Atunci când acțiunea soluțiilor apoase ale sărurilor de Cr (III), format prin gel alcalin sau amoniac precipita Cr (OH) 3 x hidroxid nh2 O. în solubilitate redusă în apă C1-10 7% în greutate, la 25 ° C Culoarea sa (albastru, verde, verde-negru sau violet), precum și activitatea chimică, depinde de condițiile de depunere. Hidroxidul este ușor solubil în acizi minerali și soluții alcaline. Pe măsură ce precipitațiile ajung, reactivitatea lor scade. Când precipitarea este uscată, se formează hidratul de Cr (OH) 3 x 3H20, care poate fi obținut sub formă cristalină. formă; structură hexagonală. (a = 1,230 nm, c = 0,970 nm, z = 8; alte date, a = 0,531 nm, c = 0,487 nm); densitate 1,64 g / cm 3. Este stabilă scăzută, în timpul depozitării și, de asemenea, când este încălzită
70 ° C trece în hidratul amorf Cr2O3 x 5H2O, stabil până la
85 ° С. Cu o deshidratare suplimentară, se obține hidroxidul amorf Cr (OH) 3. Se cristalizează în structura bayerită Al (OH) 3. hexagon. (a = 0,5288 nm, c = 0,4871 nm, z = 2), o densitate de 2,90 g / cm3; este deshidratat la aproximativ 150 ° C. Hidroxidul este utilizat pentru a produce săruri de Cr (III), catalizatori, feriti.
De asemenea, se cunoaște hidratul - verde smarald sau verdele lui Giye, cu compoziția Cr2O3 x nH2O, unde n variază de la 1,5 la 2; nu este solubil în acizi minerali, soluții alcaline, ușor solubile în soluții de CrO3. Rezistent la aer. Când este încălzit
200 ° C pierde cea mai mare parte a apei (H2O este de 0,5), dar atunci când este expus la aer din nou absoarbe. Complet deshidratat la aproximativ 600 ° C A fost preparat prin calcinarea unui amestec de K2 Cr2 O7 H3 BO3 la 500-600 ° C, urmată de levigare hidroxidului Cr prin încălzire într-o autoclavă cu adaos de acid boric sau silicic, sau prin reducerea Na2 Cr2 O7 în organice-te (de exemplu, melasa) într-o autoclavă. Aplicați ca pigment.
SrOON oxihidroxid (sau Cr2 O3 x H2O) este cunoscut ca (mineral Grimaldi) modifikatsiy.Modifikatsiya multiple formează cristale de culoare gri-albăstruie, albastru-verde sau maro-roșu; are rhombohedric. Structura (a = 0.2960 nm, c = 1,329 nm, z = 3, grup spațial ;. o densitate de 4,12 g / sm.Modifikatsiya verde (mineral gvianait) are zăbrele rombich (a = 0,4861 nm b. = 0.4292 nm și c = 0.2960 nm, z = 2, spații de grup EPTA); densitate 4,57 g / cm 3. a treia modificare (minerale bresuellit) de culoare roșu-brun are o structură de tip rombich diaspor (a. = 0,449 nm, b = 0,986 nm, c = 0,297 nm, z = 4, grupul spațial Rbpt). descris verde smarald-modificare, prea ortorombice, structura boehmit tip (spații. grup CMCM). Există indicii pentru existența unei alte unul, cubic, m gri-violet de colorare.
Oxioxidul este stabil în aer, practic nu reacționează cu acizii minerali și soluțiile alcaline. Comportamentul în timpul încălzirii diferă pentru diferite modificări. Forme de deshidratare la 370-440 ° C, modificări la 480-550 ° C, modificări la 520-570 ° C SUN se formează cu deshidratare parțială a hidroxidului Cr (III). Split. produs atunci când se obține Cr2O3.
Dioxidul de CrO2 cristalizează într-o structură de tip rutil; conform unor date, are o regiune de omogenitate (raport de O: Cr de la 1.901 la 2.013); ferromagnet, posedă metalic. conductivitate; la 110 ° C trece în paramagn. stat (fără a schimba structura). la
510 ° C se descompune la Cr2O3. În aer este stabil, cu fierbere prelungită în apă, este disproporționat pe CrOH și H2 CrO4. Sub acțiunea acidului clorhidric, îl oxidează prin eliberarea Cl2. Obținută prin descompunerea CrO2 a CrO3 sau Cr5O12 sau Cr3O8 în condiții hidrotermale; substanță activă a purtătorilor de magneziu. de înregistrare.
Este cunoscut un paramagnum amorf. forma CrO2 este maro sau negru. Acesta conține urme de apă și este de obicei puțin mai puțin oxigen; formula ei este scrisă uneori Cr5 O9 x aq. Când este complet deshidratat, se descompune. Ca hidrat al dioxidului, se poate lua în considerare hidroxicromatul [Cr (OH) 2] 2 CrO4. care iese din soluții care conțin Cr (III) și Cr (VI) la pH 3-4; o substanță amorfă cu raze X care conține o cantitate suplimentară de 5-5,5 molecule de apă; o jumătate de produs în prepararea anumitor compuși Cr.
gidroksohromaty Descrisă Cr (III) - este Cr (OH) 2 (NSrO4) x 4H2O (atunci când în picioare lichidul mamă este convertit în x SrO2 2H2O) și SR5 (OH) 9 (SrO4) 3 x PN2 O. Toate aceste amorfe , este ușor de solubil în acizi minerali diluanți și soluții alcaline, atunci când sunt încălzite, sunt deshidratate și
250 ° C se descompun. Cromocromații cromului (III) cu formula generală xCr2O3 x yCrO3 x nH20 sunt adesea numiți cromați cromați.
Existența oxizilor de Cr4O7 și Cr6O11 a fost subliniată.
Oxid cromat de cromat Cr5O12 (VI) (III). Evident, o compoziție variabilă de fază a cărei regiune omogenitate se situează în intervalul de compoziții SrO2,4 - SrO2,48 (conform altor date de la SrO2,385 la CrO2,430.). Fine ace negre. Nu este solubil în apă, solubil în acizi minerali diluanți; oxid, obținut la presiuni înalte, descompune concentrația conc. H2S04 la reflux. Datele prezentate în tabelul. parametrii structurali se referă la materiale nonferomagnetice. modificarea presiunii înalte. Structura feromagnetului. (densitate 3,29 g / cm3) a modificării de joasă presiune nu a fost studiată.
Cr2O5 conține de asemenea crom în două stări de oxidare, formula sa structurală fiind Cr2 (CrO4) 2 (Cr2O7). Noi descriem două modificări - monoclinic cu temperaturi de Neel antiferomagnetism sub 80 K și la presiuni ridicate rombic existente, pentru care formula SR6 O15 propuse. Acestea sunt cristale lamelare neagră. Nu reacționați cu apă și cu acizi diluați, solubili în soluția conc. H2 SO4 la temperatura camerei. Se obține prin descompunerea termodinamică a Cr03 sau Cr3O8 într-o atmosferă de O2 (270-300 ° C).
Ca hidrat de Cr205, este posibil să se considere cromat de hidroxid Cr (OH) Cr2O7 x2H2O precipitat din soluții apoase. Este o substanță amorfă maronie, solubilă în acizi diluați și alcalini; la 100-160 ° C este deshidratat, la 250-350 ° C se descompune.
Cr3O8 [sau oxidul de Cr2 (Cr2O7) 2 (Cr3O10) este cristale foarte fine de culoare brun închis; antiferromagnet, temperatura Néel
Enciclopedii chimice. Volumul 5 >> La lista articolelor
Articole similare
Trimiteți-le prietenilor: