Comportamentul unui gaz real este cel mai simplu și calitativ corect. este ecuația lui van der Waals:
(P + a / n2) · (n-b) = R · T. (6.3)
a, b sunt constante, prima ia în considerare forțele de interacțiune, a doua ia în considerare dimensiunea moleculelor.
a / n 2 - caracterizează presiunea suplimentară. sub care este gazul real datorat forțelor de coeziune dintre molecule și se numește presiune internă. Pentru corpurile lichide, această presiune are valori mari (de exemplu, pentru apă la 20 ° C este de 1050 MPa), iar pentru gaze, din cauza forțelor de legare scăzute ale moleculelor, este foarte mică. Prin urmare, presiunea externă. sub care există lichid. are un efect nesemnificativ asupra volumului său, iar fluidul este considerat incompresibil. În gaze, ținând seama de mica valoare a a / n 2, presiunea externă își modifică ușor volumul.
Ecuația van der Waals reflectă calitativ corect comportamentul substanțelor lichide și gazoase. pentru starea în două faze nu este aplicabilă.
Diagrama PV (figura 6.1) prezintă izotermele construite de ecuația lui van der Waals. Se poate observa din curbe că la temperaturi relativ scăzute există regiuni inundabile. Cu cât este mai mare temperatura. mai scurte acele părți ale curbelor. Aceste curbe inductive indică o tranziție continuă de la o stare lichidă la o vapori la o temperatură dată. Punctul A corespunde cu starea lichidului. punctul B se referă la starea de vapori a substanței.
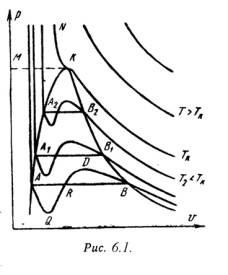
În realitate, tranziția de la starea lichidului la starea de vapori are loc întotdeauna printr-o stare de materie în două faze. La această temperatură, procesul de tranziție are loc și la presiune constantă. Această tranziție efectivă de la starea lichidului la vapori este reprezentată de linia dreaptă AB.
Practic, pentru substanțe deosebit de pure, este posibil să se facă secțiuni ale curbei de formă a undelor AQ și DB. În primul caz, au loc stări instabile ale lichidului supraîncălzit. iar în al doilea - abur suprins.
La o anumită temperatură, izotermia ecuației lui Van der Waals nu va avea o secțiune asemănătoare undelor (punctul K). Această temperatură se numește critică. Dacă conectăm punctele A1. A2. A3 ... și B1. B2. B3. obținem o curbă similară unei parabole. Curba AK este numită curba inferioară a limitei și corespunde punctului de fierbere al lichidului. Curba KV este denumită curba limită superioară și corespunde stării vaporilor uscați saturați.
Astfel, pentru o substanță reală PV - diagrama poate fi împărțită în 3 zone:
1 - regiunea stării lichide, este situată la stânga curbei limită inferioară;
2 - regiunea de stări în două faze (vapori umedi), situată între curba inferioară și superioară;
3 - zona de abur supraîncălzit. este situat în partea dreaptă a curbei superioare a limitei și deasupra punctului critic. Condiționat, regiunea lichidului este mărginită în partea de sus de linia KM - izobar critic.
Relația dintre parametrii critici și constantele ecuației van der Waals:
Ecuația lui van der Waals pentru densitățile mari de gaze dă erori semnificative. În plus, sa demonstrat experimental că coeficienții a, b depind de temperatură și presiune. iar această dependență este foarte complicată.
MPVukalovici și II Novikov în 1939 au propus o nouă ecuație universală pentru starea gazelor reale, luând în considerare asocierea și disocierea moleculelor lor. care are următoarea formă:
(P + a / n 2) · (n - b) = R · T (1 - C / (n · T (3 + 2m) / 2) (6,6)
C, m - constante, determinate pe baza datelor experimentale.
Articole similare
-
Prezentare pe tema proprietăților și proceselor termodinamice ale gazelor reale
-
Intoxicația alcoolică, starea de intoxicație alcoolică, gradul și semnele de intoxicație alcoolică
Trimiteți-le prietenilor: