Stări agregate de metale lichide
Există patru stări fundamentale ale materiei: lichid, solid, gazos și plasmă, dintre care primele două procese sunt atribuite proceselor de turnătorie.
În condiții normale, structura metalică este o latură de cristal. Cristalul este considerat drept setul corect de atomi, care nu au neapărat aceeași natură. Fiecare atom își ia locul, determinat de natura relației sale geometrice cu zăbrelele cristaline și caracterizând poziția medie a centrului acestui atom (figura 1).
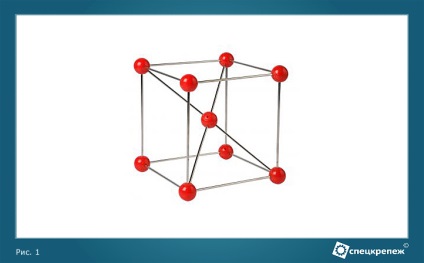
Figura 1 - Structura de fier din fier
De fapt, atomul efectuează vibrații termice în spațiul dintre atomii învecinați. Atunci când se încălzește într-un anumit moment, vibrațiile termice devin atât de puternice încât ordinea dintre atomi este distrusă, iar metalul intră într-o stare lichidă.
Metalele lichide, ca și alte lichide, ușor supraîncălzite deasupra punctului de pornire a cristalizării, sunt mult mai aproape de structura și proprietățile corpului solid decât de gaze. Acest lucru este indicat de o serie de factori:
- La topirea substanței funcție de stare (δ H entalpie schimbare și variația de entropie δ S) variază în funcție de un ordin mai mic decât starea funcțională corespunzătoare, prin sublimare (trecerea directă de la solid la starea gazoasă) sau în timpul evaporării (trecerea de la lichid la gazos).
- Proprietățile fizice ale metalelor topite se modifică semnificativ mai puțin decât în timpul sublimării sau evaporării. De exemplu, volumul specific al majorității metalelor a crescut cu topirea 5-10%, în timp ce în același timp, crește evaporarea mii de ori. Metale solide la o temperatură apropiată de punctul de topire, au o anumită fluiditate, de exemplu, atunci când rulare, o schimbare de fluid caracteristică de rezistență (sau felie), dar, în condiții normale, nu este suficient de pronunțată din cauza fluidității ridicate. Gazele practic nu rezistă formării. Astfel de proprietăți, cum ar fi permeabilitatea magnetică, conductivitatea electrică, conductivitatea termică etc., atunci când se topesc metalele, deși variază, dar numai cu câteva procente.
- Cu ajutorul studiilor de difracție cu raze X ale metalelor topite cu topire topită, supraîncălzite deasupra punctului lichidus cu doar câteva grade, se stabilește că particulele din lichide nu sunt distribuite aleatoriu. Localizarea lor în lichid este aproape de caracteristica unui solid aproape de topire.
Teoriile moderne ale fluidelor într-un fel combinat preexistenta două poziții extreme asupra naturii acestor fluide și permit caracteristici comportamentale duale care sunt derivate din poziția intermediară a stării agregat lichidă a substanței.
Metalologii de metal, de exemplu, B. Chalmers, cred că lichidul este o colecție de atomi și molecule care vibrează cu energie medie
3 kT / 2 (constanta K Boltzmann = 1,38, 10-23 J / deg) și cu o frecvență medie ν. Fiecare atom intră într-o anumită formare (cluster) asemănătoare cristalului, orientate aleatoriu. O parte din spațiul dintre ele rămâne atomi neplăsmuți. Clusterele (Figura 2) apar foarte repede și se dezintegrează imediat datorită tranziției atomilor de la unul la altul prin vacanțe - goluri intermediare. Probabilitatea apariției și numărul de micro-nuclee ale fazei solide este determinată de legile fizicii statistice. În orice moment în fluid există o ordine semnificativă pe termen scurt, atunci când fiecare atom este conectat la un altul și chiar la mulți alți vecini, în același mod ca într-un cristal.

Figura 2 - Cluster
În concordanță cu teoria fluctuațiilor unui lichid, devin spontan deviații locale față de concentrația medie, numărul și probabilitatea cărora sunt dictate de legile mecanicii statistice.
Pentru a explica proprietățile specifice ale topiturilor lichid utilizate Stewart și teoria Benz, potrivit căreia lichidele sunt distruse în mod continuu și gruparea particulelor elementare numite roiuri sau sibotaksisami. Aceste grupuri sunt formațiuni instabile și nu au limite clare.
Conform modelului cluster al lui Arharev și al lui Novokhatsky, topirea este o combinație de clustere și o zonă dezordonată. Clusterele sunt caracterizate de o anumită ordonare a structurii părții centrale și instabilitatea părților periferice. Pe măsură ce crește temperatura, clusterele se defalc pe cele mai mici, în timp ce ele se coagulează cu răcirea metalului.
Semnificația de bază a teoriei general acceptate a lui Ya.I. Scopul lui Frenkel este că tranziția de la starea solidă la cea lichidă este cauzată de o creștere spasmodică a numărului de posturi vacante. Aceasta determină o mobilitate mai mare a particulelor și a lichidului în ansamblu și explică, de asemenea, saltul în solubilitatea multor substanțe atunci când se topește solventul. Excesul necesar de energie este asigurat de fluctuații. Locurile de muncă (găuri) au o dimensiune de ordinul 10-10 m. Potrivit lui Thompson, lucrarea de formare a unei cavități sferice într-un lichid cu raza r este egală cu:
Lucrarea δZ este comensurabilă cu căldura de evaporare. Important este faptul că, pentru a transforma un lichid într-o stare cristalină, este necesar să se îndepărteze căldura corespunzătoare căldurii latente de fuziune la temperatura de transformare. În acest caz, atomii sunt transformați în poziții cu o energie potențială mai mică decât în lichid. Cu toate acestea, în ambele cazuri, fiecare atom are o energie minimă liberă, dar în lichid aceste minime sunt mai mari decât în cristal.
În majoritatea cazurilor, densitatea topiturii este mai mică decât cea a cristalului. Cristalele de germaniu, siliciu, galiu și bismut sunt mai puțin dense decât topiturile lor, iar proprietățile elastice sunt asigurate exclusiv prin ordonarea atomilor.
Există și alte teorii ale stării lichide, dar niciuna dintre ele nu ne permite să calculam proprietățile sale microscopice din parametrii particulelor elementare ale unui lichid. Ele nu oferă o explicație a numeroaselor fenomene care sunt observate într-un lichid, de exemplu, posibilitatea unei supracooleri semnificative.
Similaritatea stărilor lichide și cristaline este în principal în natura interacțiunii interparticulare și a proprietăților termodinamice, dar există o diferență fundamentală în structura corpurilor lichide și solide. Randomitatea cunoscută în aranjarea particulelor în lichid și mobilitatea lor mare, care leagă lichidul cu gazele, sunt combinate cu o interacțiune puternică între particule, ca într-un solid. Această combinație provoacă un complex de proprietăți caracteristice doar stării lichide a materiei.
densitate
Densitatea metalului este judecată de libertatea structurii sale. Densitate - una din caracteristicile fizice de bază ale topiturii, legate direct de tensiunea superficială, capacitatea termică, viscozitate dinamică, căldura soluției etc. Faza lichidă are o densitate de doar puțin mai mică decât produsul solid, dar este mai multe ordine de densitatea gazului de magnitudine mai mare .. Cel mai simplu de litiu metalic are o densitate de 0,53 g / cm3 și cea mai grea densitate iridium 22,4 g / cm 3. Fierul de densitate 7,87 g / cm 3. Pentru majoritatea metalelor asupra încălzire de la temperatura camerei până la temperatura de topire scade densitate 3-5% din fier este redus la 7,35 g / cm 3. In procesul de topire a densității majorității metalelor este redus cu câteva% din fier - până la 7,02 g / cm 3. o galiu densitate, bismut, antimoniu, germaniu și siliciu în timpul topirii crește, ca și în apă, pentru care această creștere este de aproximativ 11%.
Atunci când metalele lichide sunt încălzite, ca și în stare solidă, densitatea scade. Cu o precizie suficientă pentru practică, se folosește următoarea relație:

Selecția compoziției aliajelor este asigurată de o densitate dată și de coeficientul de dilatare liniară. Acest lucru este important, de exemplu, pentru produsele armate (confecționate din materiale diferite), care servesc la variații pe o gamă largă de temperaturi
Importanța practică a modificărilor de densitate de metal înainte și în timpul procesului de cristalizare este că acesta determină contracția volumetrică (sau creștere), care sunt asociate cu goluri de contracție, slăbirii, presiunea în porțiunile exterioare și interioare ale lingouri, blocuri și piese turnate (Figura 3).
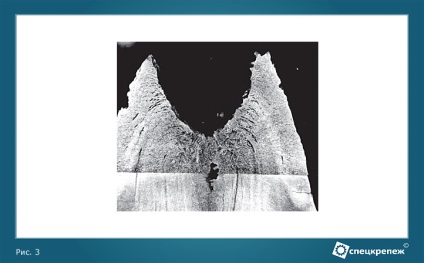
Figura 3 - Chiuveta de contracție într-un lingou
Punctul de topire este singura temperatură la care faza solidă cristalină coexistă în echilibru cu lichidul. Pentru un element pur sau un compus pur, această valoare este constantă și depinde doar puțin de presiune.
De obicei metalul care se toarnă se supraîncălzește deasupra punctului de topire cu 100 sau mai multe grade. Pe baza acestei temperaturi, se selectează materialul matriței de turnare și căptușelii gletierelor de turnare. Metalului mercur utilizate în mod obișnuit are cel mai scăzut punct de topire - minus 39 0 C, iar cel mai înalt momentul în care tungsten - 3410 0 C. fier pur topește la 1539 0 C, cupru - la 1083 0 C, aluminiu - la 660 0 C. Titanium aliajele 1580-1720 0 C.
Oțel 1420-1520 0 C
Fontă 1150-1250 0 С
Bronz 1000-1150 0 С
Alama 900 - 950 0 С
Aliaje de aluminiu 580- 630 0 C
Aliaje de magneziu 600-650 0 C
Aliajele de zinc 390- 420 ° C
Deoarece tranziții de fază sunt însoțite de efecte termice, modificări de volum și de tensiunile de fază, acestea sunt luate în considerare prin stabilirea răcirea optimă a lingourilor, țagle și piese turnate, precum și în considerare procesele de formare și structura de separare a fazelor.
Vâscozitatea unei topituri metalice este cea mai caracteristică caracteristică din punct de vedere structural și este determinată de interacțiunea interparticulei. Prin urmare, acest indice permite estimarea structurii topiturii, a naturii și a forțelor de interacțiune dintre componente în aliaje și, de asemenea, relația dintre starea solidă și cea lichidă.
Pentru a caracteriza vâscozitatea fluidului, se adoptă un coeficient de vâscozitate sau o frecare internă. denumită vâscozitate dinamică. Este numeric egal cu forța de frecare dintre două straturi, cu o suprafață egală cu una cu un gradient de viteză egal cu unul.
În metale, viscozitatea dinamică crește odată cu creșterea punctului de topire. Pentru toate metalele, aceasta scade odată cu creșterea temperaturii de încălzire. Aliajele de compoziție eutectică au de obicei valori mai mici ale vâscozității. Schimbarea vâscozității din compoziția aliajelor variază ambiguu, într-o manieră complexă și depinde de forțele de interacțiune interparticule. Contaminarea topiturilor cu particule suspendate de zgură sau oxizi este însoțită de o creștere accentuată a vâscozității.
Datele comparative de vâscozitate (Pa.S):
Apă (25 ° C) - 0,00089;
Oțel (1600 ° C) - 0,0050 - 0,0085;
Fier (1600 0 C) - 0,0045 - 0,0050.
Tensiunea superficială este numeric egal cu numărul de suprafață liberă de energie pe unitatea de suprafață de interfață între substanța avută în vedere și în vid. Tensiunea superficială cauzează higroscopicitatea oțelului și adeziune afectează natura și amploarea jetului de oxidare secundară a metalului în timpul turnării din cuptorul de topire și turnare. Perioada de cristalizare a fenomenelor de suprafață afectează concentrațiile de suprafață și de volum ale componentelor modifică substanțial formarea structurii, capilare cinetica de transfer de masă, nucleația, coagulare și flotația incluziuni nemetalice. Tensiunea interfacială la limita de metal-zgură determină în mare măsură asimilarea incluziuni nemetalice formate în timpul dezoxidare, zguri sintetice de prelucrare a metalelor și turnarea sub atmosferă protectoare.
Pe măsură ce temperatura de topire a metalului crește, tensiunea superficială tinde să crească. Deci, pentru mercur, fier și tungsten este egal, respectiv N / m: 0,45; 1,8 și 2,5. Supraîncălzirea metalelor lichide la 100 ° C scade tensiunea superficială cu aproximativ 2-4%.
Aditivii activi de suprafață, care se dizolvă în cantități foarte mici în metalul de bază și diferă puternic de la bază în proprietățile lor, reduc în mod semnificativ tensiunea superficială a topiturilor. Astfel, 0,1% din oxigen reduce tensiunea superficială a fierului la 1,1 N / m, 0,1% potasiu reduce tensiunea superficială a mercurului cu un factor de 2.
Proprietățile care afectează în mod direct producția de lingouri și piese turnate de calitate cerută sunt numite turnătorii. Ele depind de proprietățile fizice și chimice complexe, care se manifestă în fazele care rezultă în timpul răcirii topiturii, dar nu în întregime determinate de acestea. Prin turnare proprietăți includ fluiditate, iar gradul de ocupare a matrițelor, contracția și procesele asociate diferitelor defecte, tendința de formare a defectelor pe baza nemetalice și interacțiune activitate incluziuni de gaz cu mediul și materialele care conțin, tensiunile de turnare cristalizare primară și secundară și rezistență la fisurare, eterogenitatea chimică și structurală. Cea mai bună combinație a proprietăților de turnare este posedată de aliajele cu o cantitate mare de eutectic. Proprietățile de turnare ale fontei sunt mult mai mari decât proprietățile de turnătorie ale oțelului.
Articole similare
Trimiteți-le prietenilor: