Sulful este un element chimic situat în a treia perioadă din grupul VIA al Tabelului periodic. Universitatea Mendeleev.
Numărul de ordine este 16. Structura atomului este prezentată în Fig. 1. Non-metal al familiei p.
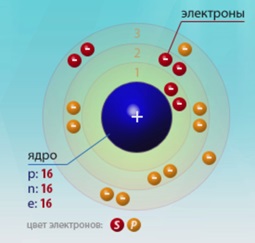
Fig. 1. Diagrama structurii atomului de sulf.
În condiții normale, sulful este un cristale de culoare galben casante, care se topesc la o temperatură de 112,8 ° C Densitate 2,07 g / cm 3. insolubil în apă, dar destul de solubil în sulfură de carbon, benzen și alte lichide. Pentru evaporarea sulfului lichid din soluție sub formă de cristale galben transparent sistem ortorombic având forma octaedrii (modificarea ortorombică).
Dacă sulful topit se răcește lent și într-un moment în care este parțial întărită pentru a fuziona nu a avut încă timp să se întărească lichidul poate obține un lung cristale de culoare închisă galben aciculare ale sistemului monoclinic (modificarea monoclinic). Densitate 1,96 g Punct / cm3 de topire 119,3 ° C
Masa molară a sulfului este de 32,065 g / mol. Această valoare indică raportul dintre masa substanței (m) și numărul de moli ai substanței (n), notat cu M și care poate fi calculat prin formula:
Cu alte cuvinte, masa molară a substanței este masa unui mol de substanță, exprimată în g / mol sau kmol.
Deoarece, indiferent de modificarea sulf este în stare solidă sau lichidă, dar nu și de gaz, pentru a găsi valoarea greutății sale moleculare nu se poate utiliza valoarea volumului molar, sau pentru a face calcule folosind formula Mendeleev-Clapeyron.
Exemple de rezolvare a problemelor
Care este masa de sulf necesară pentru producerea sulfurii de aluminiu Al2S3 cu o masă de 30 g? În ce condiții se poate obține acest sulfid din substanțe simple?
Să notăm ecuația reacției pentru obținerea sulfurii de sulf:
Calculăm cantitatea de substanță sulfură de aluminiu (masa molară - 150 g / mol):
Conform ecuației de reacție n (Al2S3). n (S) = 1: 3, atunci:
n (S) = 3 x 0,2 = 0,6 mol.
Apoi masa sulfului va fi egală (masa molară - 32 g / mol):
m (S) = n (S) x M (S);
m (S) = 0,6 x 32 = 19,2 g.
Articole similare
Trimiteți-le prietenilor: