ARN mic de interferență
Revizuirea se concentrează asupra ARN-urilor mici care interferează care sunt implicate în reglarea expresiei genelor
ARN mica interferand (siRNA)
Lungimea siRNA este de 21-25 bp. ele sunt formate din dsARN. Sursa acestor ARN-uri poate fi infecțiile virale, construcțiile genetice introduse în genom, părul lung de păr ca parte a transcrierilor și transcrierea bidirecțională a elementelor mobile.
ARN-ul dsRNA este tăiat cu Ricasa Dicer în fragmente de lungime de 21-25 bp. cu nucleotidele 2 'proeminente la capătul 3', după care unul dintre fire este parte a RISC și direcționează tăierea ARN-urilor omoloage. În RISC, sIRNA este prezentă, corespunzând atât undelor plus și minus ale dsARN. siRNA nu au propriile gene si sunt fragmente de ARN-uri mai lungi. siRNA directioneaza taierea ARN-ului tinta, intrucat este complet complementara acestuia. În plante, ciuperci și nematode, ARN-polimerazele dependente de ARN sunt implicate în procesul de supresie a expresiei genice. pentru care sIRNA servește și ca primeri (primeri pentru sinteza unui nou ARN). DsARN-ul format este tăiat în Dicer, se formează noi ARN-uri, care sunt secundare. Aceasta amplifică semnalul.
Interferența ARN
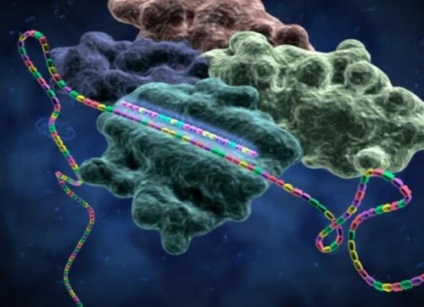
Interferența ARN
Luați în considerare schema de interferență ARN descrisă mai sus în dinamică
Rolul în procesele celulare
Care este semnificația sIRNA în celulă?
siRNA sunt implicati in protejarea celulelor de virusi. reprimarea transgenelor, reglarea unor gene și formarea heterocromatinei centromerice. O funcție importantă a siRNA este suprimarea expresiei elementelor genetice mobile. O astfel de suprimare poate să apară atât la nivelul transcripției, cât și la nivelul post-transcripțional.
Genome unele dintre virusurile constau din ADN-ul, unele bine - din ARN și ARN în virusurile pot fi atât mono sau dublu catenar. În acest caz, procesul de tăiere în sine este străină (virale) ARNm în același mod ca cel descris mai sus, adică prin activarea complexului enzimatic RISC. Cu toate acestea, pentru plante și insecte mai eficiente au inventat un mod original pentru a spori efectul protector al siARN. Aderarea lanț ARNm, siARN prin porțiunea poate Dicer complex enzimatic primul finisaj al doilea ARNm de lanț și apoi se taie în diferite locuri, creând astfel o varietate de ARNsi „secundar“. Acestea, la rândul lor, formează RISC și mARN se realizează prin toate etapele care au fost discutate mai sus, până la distrugerea ei deplină. Aceste molecule „secundare“ se pot lega în mod specific, nu numai la acea porțiune a ARNm viral, care a fost trimis la molecula „primar“, dar și la alte domenii, ceea ce crește dramatic eficiența apărării celulare.
Astfel, în plante și animale inferioare organisme ARNsi sunt o parte importantă a unui fel de „imunitate intracelulară“, care permite să recunoască și să distrugă rapid ARN străin. În cazul în care un virus care conține ARN intră în celulă, un astfel de sistem de protecție nu îi va permite să se înmulțească. În cazul în care virusul cuprinde ADN-ul, sistemul siRNA va preveni producerea de proteine virale (deoarece este necesar pentru acest ARNm este recunoscută și tăiată), iar această strategie va incetini raspandirea acesteia pe tot corpul.
La mamifere, spre deosebire de insecte și plante, funcționează un alt sistem de protecție. Când un ARN străin, a cărui lungime depășește 30 bp, intră în celula "matură" (diferențiată) a mamiferelor. celula începe sinteza interferonului. Interferonul, care se leagă la receptorii specifici de pe suprafața celulei. poate stimula un întreg grup de gene în celulă. Ca rezultat, mai multe tipuri de enzime sunt sintetizate în celulă care inhibă sinteza proteinelor și descompun ARN-ul viral. În plus, interferonul poate acționa asupra celulelor învecinate, dar neinfectate, blocând astfel eventuala răspândire a virusului.
După cum puteți vedea, cele două sisteme sunt similare în mai multe moduri: ele au un scop comun și „metodele“ ale lucrării. Chiar și numele „interferon“ si „interferenta (ARN)“ descinde dintr-o rădăcină comună. Dar există, de asemenea, o diferență foarte semnificativă: dacă interferonul la primul semn al unei invazii pur și simplu „îngheață“ celule de lucru, nu permite (doar în cazul), producția de mulți, inclusiv „inofensivă“ de proteine in celula, sistemul siARN diferă inteligibilitatea extraordinară : fiecare SIRNA va recunoaște și distruge numai propriile lor ARNm specifice. Înlocuirea numai o nucleotidă în siARN duce la o reducere drastică a efectului interferenței. Nici unul dintre gene blocante cunoscute până în prezent, nu are nici o astfel de specificitate excepțională pentru gena țintă.
Descoperirea interferenței cu ARN a dat noi speranțe în lupta împotriva SIDA și a cancerului. Poate folosind terapia siARN impreuna cu terapia antivirală convențională se poate realiza efectul potențării atunci când două acțiuni conduc la un efect terapeutic mai pronunțat decât suma fiecărui aplicat în mod individual.
Pentru a utiliza mecanismul de interferență cu siARN în celulele de mamifere, moleculele de siARN dublu catenar deja gata trebuie introduse în celule. Dimensiunea optimă a unui astfel de sIRNA sintetic este de 21-28 nucleotide. Dacă creșteți lungimea sa - celulele răspund cu producția de interferon și o scădere a sintezei proteinelor. Celulele sintetice sintetice pot intra în ambele celule infectate și sănătoase, iar scăderea producției de proteine în celulele neinfectate va fi extrem de nedorită. Pe de altă parte, dacă încercăm să folosim siRNA mai puțin de 21 de nucleotide, specificitatea legării sale la ARNm dorit și capacitatea de a forma complexul RISC sunt reduse drastic.
Dacă vom reuși într-un fel sau altul pentru a livra SIRNA, care are capacitatea de a se lega la orice parte a genomului HIV (care, după cum știm, este format din ARN), puteți încerca să prevină încorporarea sa în ADN-ul celulelor gazdă. In plus, oamenii de știință dezvoltă modalități de a influența diferitelor stadii ale reproducerii HIV într-o celulă infectată. Această din urmă abordare nu va oferi un remediu, dar poate reduce semnificativ rata de replicare virală și a da încolțit sistemul imunitar o șansă de „odihnă“ de la un atac de virus, și cel mai încerca să se ocupe cu rămășițele bolii. Cifra celor două etape ale reproducerii HIV in celula, care, așa cum oamenii de știință speră, poate fi blocat cu ajutorul siARN, marcate cu cruci roșii (pașii 4-5 - integrarea în cromozomul virusului, și etapele 5-6 - asamblarea virusului și în afara celulelor).
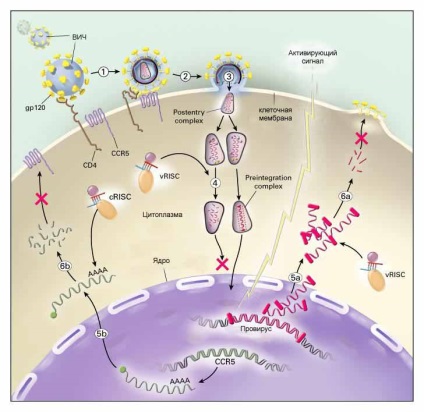
Până în prezent, totuși, toate cele de mai sus se aplică numai domeniului teoretic. În practică, terapia cu siRNA se întâlnește cu dificultăți pe care oamenii de știință nu pot să le depășească. De exemplu, în cazul terapiei antivirale, este specificitatea ridicată a siRNA care poate juca o glumă crudă: se știe că virușii au capacitatea de a muta rapid, adică schimba compoziția nucleotidelor sale. Un succes deosebit în acest sens îl reprezintă HIV, a cărui frecvență de schimbare este de așa natură încât o persoană infectată cu un singur subtip al virusului poate fi identificată în câțiva ani cu un subtip absolut diferit. În acest caz, tulpina modificată HIV va deveni automat insensibilă la siARN selectat la începutul terapiei.
Aging și carcinogeneză

Ca orice factori epigenetice, efectul ARNsi asupra expresiei genelor care provoacă „tăcut“. Acum, există lucrări care descriu experimente pe oprirea genei asociate cu tumori. Genele oprit (knock-down) utilizează siARN. De exemplu, oamenii de știință chinezi folosind ARNsi oprit factor de transcripție a genei 4 (TCF4), a cărei activitate produce sindromul Pitt-Hopkins (o boala genetica rara caracterizata prin retard mintal și episoade Hiperventilatia și apnee) și alte boli mintale. În această lucrare a fost efectuat pentru a studia TCF4 rol in celulele canceroase gastric. Expresia ectopică a TCF4 reduce creșterea celulară în linii de celule canceroase, gastric, oprirea genei TCF4 de siARN îmbunătățește migrarea celulelor. Astfel, putem concluziona că gena epigenetice off (Tacere) TCF4 joacă un rol important în formarea și dezvoltarea tumorilor.
Potrivit unui studiu din cadrul Departamentului de Oncologie, Centrul de Cancer Albert Einstein, condus de Leonard H. Augenlicht, siRNA este implicata in inchiderea genei HDAC4. care determină inhibarea creșterii cancerului de colon, apoptoza și transcripția crescută a p21. HDAC4 este o deacetilază a histonei, care este specifică țesutului, suprimă diferențierea celulelor și expresia ei este suprimată în timpul procesului de diferențiere celulară. Lucrarea arată că HDAC4 este un regulator important al proliferării celulelor de colon (care este important în procesul cancerului) și este, la rândul său, reglementat de siARN.
În cadrul Departamentului de Patologie, Universitatea Națională de Medicină din Nara, Japonia, a efectuat cercetări privind cancerul de prostată. Îmbătrânirea replicativă a celulelor este o barieră împotriva divizării și carcinogenezei necontrolate. Celulele fisionabile cu durată scurtă de viață (TAC) fac parte din populația celulelor prostatice din care se formează tumora. Oamenii de stiinta japonezi au studiat motivele pentru care aceste celule depasesc imbatranirea. În celulele de prostată, sIRNA junB a fost transfectată în cultură. În aceste celule, există un nivel crescut de exprimare a p53, p21, p16 și pRb, detectat prin îmbătrânire. Celulele în cultură care au prezentat un nivel redus de p16 au fost utilizate pentru următoarea etapă. Transfectarea repetată a siRNA în TAC a permis celulelor să evite îmbătrânirea după inactivarea p16 / pRb. In plus, tacerea proton-oncogenei junB cu siRNA junB provoaca invazia celulelor. Pe baza acestui fapt, sa concluzionat că junB este un element de creștere a p16 și promovează îmbătrânirea celulară, ceea ce previne malignitatea (malignitatea) TAC. Astfel, junB este un regulator al carcinogenezei în prostată și poate fi o țintă pentru intervenția terapeutică. Și activitatea sa poate fi reglată cu ajutorul SIRNA.
Există multe studii similare. În prezent, SIRNA nu este doar un obiect, ci și un instrument în mâinile unui cercetător-medic, biolog, oncolog, gerontolog. Studiul asocierii sIRNA cu boli oncologice, cu expresia genelor asociate vârstei, este cea mai importantă sarcină pentru știință. A fost un timp foarte scurt de la descoperirea sIRNA și câte studii interesante și publicații legate de ele au apărut. Nu se poate îndoi că studiul lor va fi unul dintre pașii omenirii spre victoria asupra cancerului și a îmbătrânirii.
Trimiteți-le prietenilor: