Atomul este un sistem neutru electric care constă dintr-un nucleu încărcat pozitiv și un electron încărcat negativ.
Nucleul atomilor constă din două tipuri de particule (nucleoni) - protoni (p) și neutroni (n). Încărcarea protonului este egală cu magnitudinea și opusă semnului încărcării electronului; masa sa este de aproximativ un amu. Neutronul - o particulă neîncărcată, cu o masă aproximativ egală cu masa protonului.
Dimensiunile liniare ale atomului-
Cea mai mare parte a atomului este concentrată în nucleu și este caracterizată printr-un număr de masă A egal cu suma numărului de protoni (sarcina nucleului) Z și neutronii N: A = Z + N.
Caracteristica principală a unui atom este încărcarea nucleului (Z). Acesta determină numărul de electroni din jurul nucleului, adică apartenența unui atom la un anumit tip de elemente chimice și corespunde unui număr atomic (într-un sistem periodic de elemente - numărul ordinal) al elementului.
În desemnarea atomului elementului, numărul de masă și numărul de protoni sunt reflectate, de exemplu.
Masa atomică relativă a unui element este valoarea medie a numărului de masă al izotopilor săi naturali, luând în considerare gradul de propagare a acestora. De exemplu, clorul în natură este în principal sub forma a două izotopi - (75,43%) și (24,57%). Greutatea atomică relativă a clorului este.
Bazele teoriei moderne a structurii atomului sunt legile și pozițiile mecanicii cuantice (val), o ramură a fizicii care studiază mișcarea microobiectelor.
Microobjectele posedă atât proprietăți corpusulare, cât și valuri. Pentru a descrie mișcarea microparticulelor, se folosește o abordare probabilistică, adică nu este determinată poziția lor exactă, ci probabilitatea de a găsi un spațiu aproape nuclear în această sau regiunea respectivă.
Starea unui electron într-un atom este descrisă printr-un model cuantic-mecanic - un nor de electroni, densitatea părților sale corespunzătoare fiind proporțională cu probabilitatea de a găsi un electron. De obicei, un nor de electroni este înțeles ca o regiune a spațiului aproape nuclear, care acoperă aproximativ 90% din norul de electroni. Această regiune a spațiului este numită și orbital.
Există un sistem de numere cuantice care determină starea unui electron într-un atom.
Principalul număr cuantic determină energia electronică și mărimea norului de electroni. Poate lua valori întregi de la 1 la.
Setul de stări electronice având aceeași valoare a numărului principal cuantic n. se numește stratul de electroni sau nivelul de energie.
Valoarea cea mai mică a energiei E corespunde cu n = 1. Stările cuantice rămase corespund valorilor energetice mai mari. Electronii de la aceste niveluri de energie sunt mai puțin legați de nucleu.
Pentru un atom de hidrogen, starea cuantică cu n = 1 corespunde celei mai scăzute energii și se numește starea de bază. Stările n = 2, 3, 4 ... se numesc stări excitate.
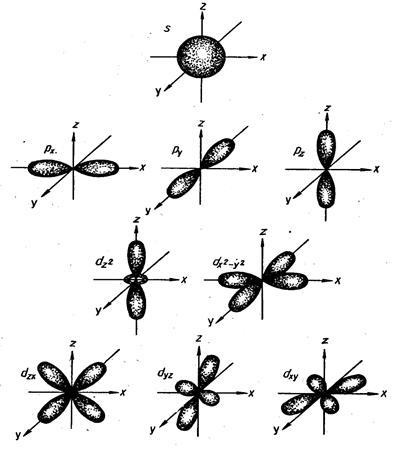
Numărul orbital (indirect) cuantic determină impulsul orbital al electronului și caracterizează forma norului de electroni. Este nevoie de toate valorile întregi de la 0 la (n -1). Fiecare n corespunde unui anumit număr de valori, adică nivelul de energie este un set de subsoluri energetice care diferă ușor între energie. Numărul de subsoluri pe care se împarte nivelul de energie este egal cu numărul de nivel (adică, valoarea numerică a n). Aceste subsoluri au următoarele denumiri de litere:
Numărul cuantumului orbital: 0 1 2 3 4
Substrat: s p d f g
Formele orbitalilor care corespund unor valori diferite sunt prezentate în figura următoare:
Dreptul periodic, deschis DI Mendeleev, în 1869, în formularea modernă citește:
proprietățile elementelor chimice, precum și formele și proprietățile compușilor pe care aceștia le formează sunt în dependență periodică de magnitudinea sarcinii nucleelor atomilor lor.
Încărcarea nucleului (numărul de protoni) este egală cu numărul atomic al elementului, determină numărul de electroni din atom și, ca o consecință, structura coajă-lui de electroni în starea de bază.
O reprezentare grafică a legii periodice este un tabel al tabelului periodic al elementelor. Formele acestei imagini sunt diferite.
Abordarea principală a construcției meselor este una - elementele sunt aranjate în ordinea crescândă a nucleului atomilor lor. Baza fizică a structurii sistemului periodic de elemente este o anumită secvență de formare a configurațiilor electronice de atomi cu creșterea numărului de serie al elementului Z.
În funcție de energia pe care supraîncălzirea este umplută cu electroni, se disting patru tipuri de elemente:
1. s-elementele - acesta din urmă este umplut cu substratul de nivel al energiei externe;
2. Elemente p - p-subsol al subsolului energetic extern;
3. d - elementele - d - subsubul penultim al nivelului de energie.
4. elementele f - f-subsolul celui de-al treilea în afara nivelului.
Elementele cu o configurație electronică similară (umplută cu aceleași subsoluri) a nivelurilor de energie externe au de asemenea proprietăți chimice similare.
O perioadă este o serie de elemente a căror configurație electronică a nivelului de energie externă variază de la ns1 la ns2np6 (pentru prima perioadă s1 și s2). În acest caz, numărul perioadei coincide cu valoarea numărului principal cuantic și a nivelului de energie externă.
Fiecare dintre perioadele (excluzând primul) începe și se termină cu un gaz nobil de metal tipic, care este precedată de un nemetal, adică odată cu creșterea atomilor nucleu perioadă de încărcare, o schimbare treptată a proprietăților din metalul în general până la non-metalic, care se leaga de a crește numărul de electroni în nivelurile de energie exterioare.
Primele trei perioade creează elemente s și p. Al patrulea și cele ulterioare, de asemenea, includ elemente în care se umple d- și f-subsilele nivelurilor energetice interne corespunzătoare. Elementele f sunt combinate în familii, numite lantanide (elementele 4f) și actinide (elementele 5f).
Coloanele verticale, numite grupuri, combină elemente care au o structură electronică similară. În varianta de scurtă durată a tabelului există doar 8 grupe, fiecare dintre ele constituind principalele și sub-subgrupurile. În elementele principalelor subgrupuri, s-și p-subvelițele nivelurilor de energie externe sunt umplute ultima, ale căror configurații electronice sunt principalul factor care determină proprietățile chimice ale elementelor. Elementele sub-subgrupurilor sunt umplute cu n-1 d- și (n-2) f-subsilevel cu 1 la 2 electroni la nivelul energiei externe.
Elementele analogice au aceeași structură a cojilor de electroni externi ai atomilor pentru diferite valori ale numărului principal cuantic n și, prin urmare, prezintă proprietăți chimice similare.
Astfel, cu o creștere succesivă a sarcinilor nucleelor atomice, configurația cojilor de electroni se repetă periodic și, ca o consecință, se repetă periodic proprietățile chimice ale elementelor. Acesta este sensul fizic al legii periodice.
Elementele principalelor și sub-subgrupurilor diferă în ceea ce privește proprietățile chimice, însă ele sunt inerente și comune, ceea ce le unește într-un singur grup - numărul grupului. Aceasta, de regulă, indică numărul de electroni care pot participa la formarea legăturilor chimice. Acesta este sensul fizic al numărului de grup.
Astfel, principalele elemente ale subgrupelor valent (adică, care participă la formarea legăturilor chimice) sunt nivelul de energie de electroni extern, în timp ce elementele laterale ale subgrupelor - și electronii penultim niveluri. Aceasta este diferența principală dintre elementele principalelor și secundare.
Deoarece configurația electronică a atomilor elementelor chimice variază în mod periodic cu creșterea responsabilă de nucleele lor, toate proprietățile determinate de structura electronică, se modifică în mod regulat de perioade și grupe ale sistemului periodic. Aceste proprietăți sunt în primul rând diferite caracteristici fizice ale elementelor :. raze atomice și ionice chimice și, afinitatea de electroni, gradul de oxidare a volumului atomic etc. Periodic variază, de asemenea, mai multe proprietăți fizice ale compușilor simpli și complecși formați prin elemente de analogi chimici și.
Atomul nu are o limită strict definită, prin urmare este imposibil să se stabilească dimensiunile sale absolute. Următoarele raze de atomi se disting.
Raza covalentă este jumătate din distanța internucleară în molecule sau cristale ale substanțelor simple corespunzătoare.
Raza de metal este jumătate din distanța dintre centrele a doi atomi vecini ai rețelei de cristal a metalului.
În plus, se disting razele ionice ale cationilor. care sunt întotdeauna mai mici decât raza atomică a elementelor corespunzătoare și razele anionilor. care sunt mai mari decât razele atomice.
Raza orbitală este distanța calculată teoretic de la miez la maximul principal al planului electron al orbitalilor principali.
Regularitatea modificărilor parametrilor luați în considerare în sistemul de elemente este de natură periodică. Cele mai frecvente sunt:
1. scăderea radiațiilor atomice în perioadele cu încărcătura nucleară în creștere;
2. În grupuri cu o creștere a încărcăturii nucleare, raza atomilor crește, în timp ce în grupurile A o astfel de creștere are loc într-o măsură mai mare decât în grupurile B.
Activitatea chimică a unui element este determinată de capacitatea atomilor săi de a pierde sau de a acumula electroni. Din punct de vedere cantitativ, acest lucru este estimat de energia de ionizare Euon a atomilor (sau potențialul de ionizare I) și de afinitatea sa la electronul Ec.
Energia de ionizare este energia minimă necesară pentru a detașa cel mai slab legat electron de atomul neefectuat (e-element):
Energia de ionizare este exprimată în kilojouli pe mol (kJ / mol) sau în volți electroni pe atom (eV / at).
Cea mai mică tensiune a câmpului electric la care este detașat electronul se numește potențialul de ionizare I (exprimat în volți - B). Valoarea numerică a lui I în volți este egală cu energia de ionizare Euon. în electron volți.
Detașarea primului electron corespunde primului potențial de ionizare I1, a doua ionizare I2, etc. Mai mult, I1 Potențialul de ionizare este o funcție complexă a unor proprietăți ale atomului: sarcina nucleului, raza atomului, configurația cochiliilor de electroni exteriori. Abilitatea unui atom de a forma ioni încărcați negativ este caracterizată de o afinitate pentru un electron. ceea ce înseamnă efectul energetic al atașării unui electron la un atom neutru în proces: Cea mai mare afinitate pentru un electron este caracterizată prin elemente din grupa VIIA. Pentru majoritatea metalelor și gazelor nobile, afinitatea pentru un electron este mică sau chiar negativă. Adăugarea a doi sau mai mulți electroni la atom este imposibilă deloc. Electronegativitatea este o valoare condiționată care caracterizează capacitatea unui atom dintr-un compus chimic de a atrage electroni în sine. Pentru evaluarea practică a acestei abilități a atomului, este introdusă o scală relativă condiționată de electronegativitate (EO). Conform unei asemenea scări, cel mai electronegativ dintre elementele capabile să formeze compuși chimici este fluorul, iar cel mai puțin electronegativ este Franța. În perioada cu creșterea numărului ordinal al elementului, EO crește, iar în grup, de regulă, scade. Numerele cuantice care determină starea unui electron într-un atom - stadopedia Cum structura sacului muscular pielii afectează natura mișcării nematodelor, biologiei
Articole similare
Trimiteți-le prietenilor: