Un echivalent al unei substanțe este cantitatea sa, care se combină cu 1 mol de atomi de hidrogen sau o înlocuiește în interacțiuni chimice.
Masa molară a echivalentului unei substanțe este masa unui echivalent al substanței; se calculează ca masa molară a substanței, împărțită la numărul echivalent de materie.
Conform legii echivalente, substanțele interacționează între ele în cantități proporționale cu echivalentele lor. Prin urmare, masa moleculară a echivalentului oricărei substanțe poate fi găsită din interacțiunea cu o altă substanță, masa molară a cărei echivalent este cunoscută.
Pentru această lucrare de laborator, veți avea nevoie de următorii reactivi:
2. HCI acid clorhidric;
3. Carbonat de calciu CaCO3.
Întrebări pentru admiterea la munca de laborator:
1. Formularea legii echivalente.
2. Care este echivalentul?
3. Ce este un număr echivalent?
4. Cum se găsește numărul echivalent de substanță simplă?
5. Cum sa gasesti un numar echivalent de oxid?
6. Cum se găsește numărul echivalent de hidroxid?
7. Cum se găsește numărul echivalent de acid?
8. Cum să găsiți un număr echivalent de sare?
Experiența numărul 1. Determinarea masei molare a echivalentului de aluminiu
În reacțiile care continuă cu eliberarea gazului, masa molară a substanței echivalente poate fi determinată prin metoda volumetrică - prin volumul gazului în evoluție.
Tehnica experienței. Într-un tub de testare, se toarnă 5-6 ml de soluție de acid clorhidric HCI și se pune proba de aluminiu Al pe marginea tubului astfel încât metalul să nu intre în contact cu acidul. Apoi, conectăm tubul la dispozitivul pentru determinarea volumului de gaz - constă din două sticle umplute cu tuburi de apă, conectate împreună de tipul vaselor de comunicare. După ce a fost marcat nivelul apei din tubul în care este conectat tubul de testare, picurăm eșantionul de metal în acid. În timpul reacției, se eliberează o substanță gazoasă, iar nivelul apei din tubul la care tubul de testare este conectat scade. Când nivelul apei din tub se stabilizează, terminăm experimentul.
În timpul experimentului, apare următoarea reacție:
Se notează datele inițiale pentru calculul masei molare a echivalentului de aluminiu în conformitate cu următorul model:
Greutatea probei este m, g;
Volumul de hidrogen eliberat este V, ml;
Temperatura experimentului este t, ° C;
Presiunea atmosferică este P, mm Hg. Art. ;
Elasticitatea vaporilor de apă este h, mm Hg. Art.
Aducem volumul de hidrogen eliberat în condiții normale prin formula:
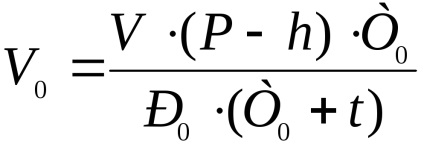
unde V este volumul de hidrogen eliberat, ml;
P - presiunea atmosferică, mm Hg;
t este temperatura experimentului, ° C;
h este presiunea vaporilor de apă la temperatura experimentală, mm Hg;
T0 este temperatura corespunzătoare condițiilor normale, K;
P0 este presiunea corespunzătoare condițiilor normale, mm Hg.
Se înregistrează calculul reducerii volumului de hidrogen eliberat în condiții normale în conformitate cu formula de mai sus, luând în considerare datele inițiale obținute.
Calculați masa molară a echivalentului de aluminiu cu formula:
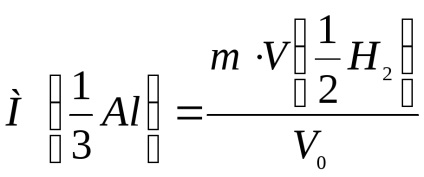
unde m este greutatea probei, g;
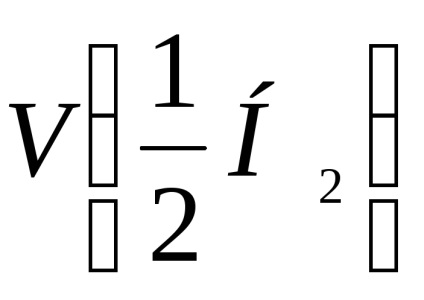
- volumul molar de echivalent hidrogen, ml / mol;
V0 este volumul de hidrogen eliberat în condiții normale, ml.
Se notează calculul masei molare a echivalentului de aluminiu conform formulei de mai sus.
Eroarea relativă a experimentului este calculată prin formula:
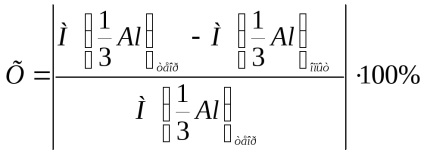
unde
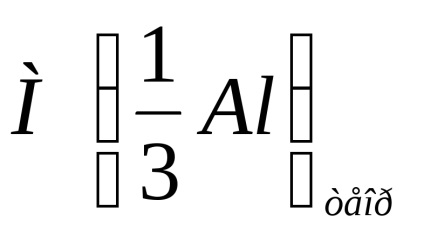
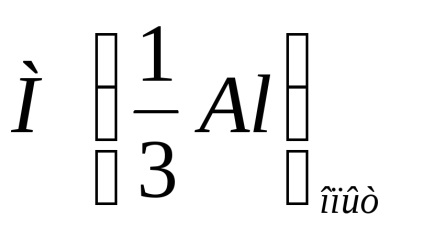
Notați calculul erorii relative a experimentului cu formula de mai sus.
Încheiați această metodă de determinare a masei moleculare a substanței echivalente și indicați cu ce eroare a fost găsită în acest caz.
Experiența numărul 2. Determinarea masei moleculare a echivalentului de carbonat de calciu
Masa molară a echivalentului substanței poate fi determinată din cantitatea de substanță reacționată cu cantitatea exactă cunoscută a celeilalte substanțe.
Tehnica experienței. Într-un tub de testare, se pune o probă de marmură (carbonat de calciu CaCO3) și se adaugă 4 ml (0,004 dm 3) soluție de acid clorhidric HCl cu o concentrație molară de echivalenți de 0,5 mol / dm3.
În timpul experimentului, apare următoarea reacție:
După ce se eliberează gazul, restul de marmură se spală, se usucă și se cântărește.
Se calculează masa de carbonat de calciu reacționată cu acid clorhidric conform formulei:
unde m1 este masa inițială a probei, g;
m2 este masa finală a probei, g.
Se înregistrează calcularea masei de carbonat de calciu reacționată cu acid clorhidric, conform formulei de mai sus.
Se calculează masa molară a echivalentului de carbonat de calciu conform formulei:
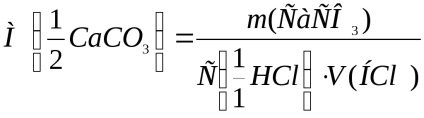
unde m (CaCO3) este masa de carbonat de calciu reacționată cu acid clorhidric, g;
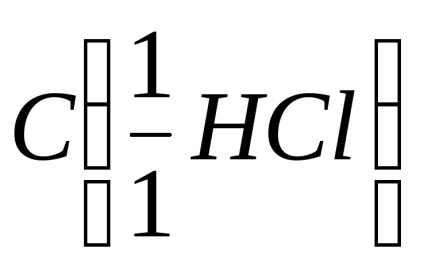
V (HCl) - volumul de acid clorhidric, dm 3.
Se înregistrează calculul masei moleculare a echivalentului de carbonat de calciu conform formulei de mai sus.
Eroarea relativă a experimentului este calculată prin formula:
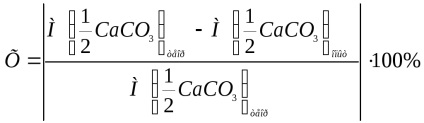
unde
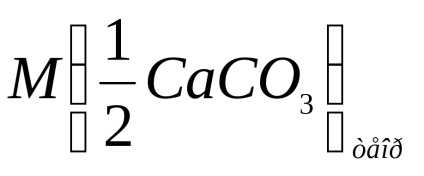
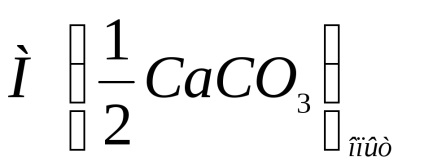
Notați calculul erorii relative a experimentului cu formula de mai sus.
Încheiați această metodă de determinare a masei moleculare a substanței echivalente și indicați cu ce eroare a fost găsită în acest caz.
Întrebări pentru protecția muncii de laborator:
1. Ce depinde numărul echivalent de interacțiuni chimice?
2. Cum se găsește numărul echivalent de schimb de ioni?
3. Cum se găsește numărul echivalent de proces de reducere a oxidării?
4. Ce este un factor de echivalență?
5. Cum pot găsi masa molară a substanței echivalente?
6. Cum se găsește masa molară a echivalentului substanței care participă la reacție?
7. Cum pot găsi cantitatea de substanțe echivalente?
8. Cum pot calcula volumul molar al echivalentului unei substanțe gazoase?
9. Ce volum va lua, in conditii normale, un echivalent de hidrogen si un echivalent de oxigen?
1. N.L. Glinka. "Chimie generală". Capitolul "Echivalent. Legea echivalenților.
2. E.M. Rybalkin, O.Yu. Kovalik. „Chimia. Ajutor vizual educațional ". Capitolul "Echivalent".
3. R.M. Belkina, V.D. Ivanova. „Echivalent. Masă echivalentă. Sarcini pentru formarea practică. "
Articole similare
-
Evaluarea completă a principalelor proprietăți ale motorinei - lucrări de laborator
-
Lucrați cu ajutorul editorului de interogări sql sql explorer (tm) pentru a vă familiariza cu
-
Lucrarea de laborator nr. 14 "Determinarea timpului și a forței medii de impact a bilelor elastice"
Trimiteți-le prietenilor: