Conductivitatea electrică (L) este capacitatea unei substanțe de a conduce un curent electric sub acțiunea unui câmp electric extern. În ceea ce privește semnificația fizică, această valoare este inversă rezistenței (R):
unde # 961; - rezistivitate, Ohm / m; S - secțiunea transversală a conductorului, m 2; l este lungimea conductorului, m.
Distingeți între conductivitățile electrice specifice și moleculare ale soluțiilor de electroliți.
Conductivitatea electrică specifică (# 954;) este conductivitatea electrică a volumului unei soluții închise între doi electrozi paralele cu o suprafață de 1 m2 situată la o distanță de 1 m una de cealaltă. Conductivitatea electrică specifică este reciprocă a rezistivității.
Unitate de măsură a conductivității electrice specifice: Ohm -1 m -1 = S / m (cm - Siemens).
Electrochimie este adesea folosit conductivitate tradițională definiție: o conductivitate electrică a lungimii coloanei de material de 1 cm și 1 cm 2, secțiune transversală cu dimensiunea ohm -1 cm -1 = S / cm.
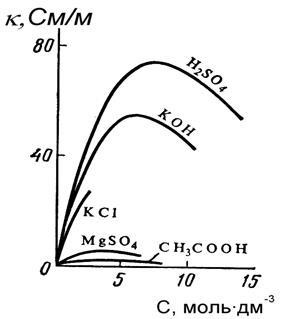
Conductivitatea electrică specifică a electroliților este determinată de numărul și încărcarea ionilor care transportă energia electrică, precum și de viteza de mișcare a acestora în câmpul electric. Grafic de dependență # 954; din concentrația soluției pentru electroliți puternici este o curbă cu un maxim clar pronunțat și pentru slab - acest maxim este în mare măsură neclar și practic nu apare (Figura 5.1). În regiunea concentrațiilor mici de soluții de electroliți puternici și slabi, creșterea conductivității electrice se datorează creșterii numărului de purtători de ioni de energie electrică.
Pe măsură ce crește concentrația, crește densitatea soluției, ceea ce reduce viteza ionilor, în timp ce în electroliții slabi gradul de disociere scade considerabil; prin urmare # 954; pentru electroliții moderat slabi începe să scadă în regiunea soluțiilor mult mai diluate și practic nu există o creștere a conductivității electrice, iar valoarea maximă pe curbă se dovedește a fi foarte slabă.
creștere a temperaturii de 1 K crește conductivitatea 2-2,5% pentru electroliți puternici prin reducerea viscozitatea soluției și etanșările ionilor hidratate, precum și soluțiile de electroliți slabi - prin creșterea gradului de disociere în cazul reacțiilor endoterme de electrolit dizolvat.
Valoarea conductivității electrice specifice, pe lângă factorii enumerați, este afectată de valența (încărcătura) ionului: cu cât este mai mare sarcina ionică, cu atât mai multă energie electrică pe care o transferă.
Conductivitatea molar electric (# 955) - conductivitatea electrică a volumului soluției de electrolit conținând 1 echivalent mol de substanță dizolvată, plasat între doi electrozi paraleli distanțate 1 m distanță. Unitatea de conductibilitate electrică molară este: A se vedea # 8729; m 2 / mol.
Conductivitățile electrice specifice și moleculare sunt legate de relația:
unde C este concentrația molară a substanței dizolvate, mol / l; # 955; - conductivitatea electrică molară, cm # 8729; m 2 / mol; # 954; - Conductivitate electrică specifică, S / m.
dependență # 955; cu privire la viteza de mișcare pentru ionii monovalenți este exprimată prin ecuația:
unde u + și u- sunt vitezele absolute ale ionilor pozitivi și negativi, respectiv, # 945; - grad de disociere a electrolitului, F - constantă Faraday.
Pentru electroliți puternici, putem lua a = 1, deci
Produsele se numesc mobilități ionice:
Pentru soluțiile extrem de diluate (C → 0, # 945; → 1) se aplică următoarea egalitate:
unde u este mobilitatea ionilor la diluția limită (infinită), sunt valori specifice pentru ioni; - conductivitatea electrică a unei soluții ipotetic infiltrate, diluată, caracterizată prin disocierea completă a electrolitului și absența forțelor de interacțiune electrostatică între ioni.
Ecuația (5.25) este valabilă atât pentru electroliții puternici cât și pentru cei slabi și se numește legea mișcării independente a ionilor Kohlraus (legea aditivității conductivității electrice). Conform legii Kohlrausch, conductivitatea electrică molară la diluția limitativă este egală cu suma mobilităților ionilor la diluția limitativă.
Valorile numerice ale mobilităților ionice sunt în prezent estimate pentru practic toate ionii și sunt date în cărți de referință. De exemplu, utilizând datele de referință, conductivitatea electrică molară a soluției de acid acetic extrem de diluat poate fi determinată:
Comparația valorilor numerice pentru diferiți ioni arată că hidroxidul de hidroxid și ionii de hidroxil prezintă valori anormal de mari ale conductivităților electrice în soluția apoasă. Acest lucru este explicat prin mecanismul releului de deplasare a acestor ioni în soluție. Prin urmare, soluțiile de acizi și alcalii, în comparație cu soluțiile de săruri la concentrații identice, au o conductivitate electrică mai mare.
În soluțiile diluate de electroliți slabi, interacțiunea electrică dintre ioni este mică, prin urmare:
Din expresia (5.26) rezultă că gradul de disociere a unei soluții a unui electrolit slab cu o schimbare a concentrației poate fi determinat utilizând date experimentale privind conductivitatea electrică molară a soluțiilor sale diluate. Deoarece electrolitul este constant, modificarea conductivității electrice a unei soluții diluate a unui electrolit slab, cu o schimbare a concentrației sale, este determinată numai de dependența a de concentrația soluției.
În soluțiile de electroliți puternici, modificarea conductivității electrice molare cu concentrație se datorează influenței interacțiunii electrostatice a ionilor asupra vitezei de mișcare a acestora.
Un grafic al conductivității electrice molar asupra concentrației soluției la electroliții slabi exprimat scădere mai accentuată odată cu creșterea concentrației decât curba aceeași dependență pentru electroliți puternici (Figura 5.2).
Figura 5.2. Dependența conductivității electrice molare a soluțiilor de electroliți slabi (1) și (2) puternici asupra concentrației acestora.
Dependența conductivității moleculare a soluției de concentrația de electroliți puternici a fost studiată de mulți cercetători. Ecuația empirică Kohlrausch pentru soluțiile diluate este cea mai cunoscută, numită legea rădăcinii pătrată :. (5.27) unde h este coeficientul empiric. Această dependență este confirmată de numeroase experimente și este fundamentată teoretic în teoria lui Debye-Hückel-Onsager.
Conform acestei teorii, scăderea conductivității electrice molar de soluții diluate de electroliți puternici cu creșterea concentrației de electrolit datorită scăderii vitezei de deplasare a ionilor datorită interacțiunilor electrostatice ale ionilor înconjurat atmosferele lor ionice, mișcarea ionilor într-un câmp electric.
metodă de cercetare bazată pe măsurarea conductibilității electrice a soluțiilor electrolitice - Conductometrie. Această metodă este suficient de simplă, precisă, vă permite să rezolvați o serie de sarcini importante de cercetare și de producție. Măsurarea conductivitatea electrică a soluțiilor, determinarea bazicitatea acizilor organici, solubilitatea și produsul solubilității compușilor solubili slab și gradul de disociere constantă a electrolitului slab, gradul de mineralizare a solului, apei și a solului. Titrare conductometrică folosită pe scară largă a diferitelor soluții (deosebit de tulbure).
Determinarea experimentală a conductivității electrice a soluției electrolitice se bazează pe măsurarea rezistenței soluției, deoarece curentul electric trece prin metoda de compensare. Pentru aceasta, se utilizează un circuit de punte (fig.5.3):
Figura 5.3. Schema de instalare pentru măsurarea rezistenței electrice a soluției: AB - Recurgeți cu valori fixe ale rezistenței în diferite poziții ale contactului de alunecare C; Rm - magazin de rezistență; Rx - un vas cu o soluție de testare a cărui rezistență trebuie determinată; G - instrument zero (galvanometru sau osciloscop); - generator de curent de înaltă frecvență.
Mutarea contactului C de-a lungul rheochordului AB, se obține absența curentului sau a acestuia minim în circuitul CD. Următoarea relație este valabilă :. de aici:
Curentul alternativ de înaltă frecvență (în circuitul de măsurare) este folosit pentru a evita efectele electrolizei pe electrozi din vas cu soluția de testare și pentru a reduce rezistența capacitivă.
Exemplul 5.3. Două plăci de nichel, fiecare cu o suprafață de 4 cm2, sunt paralele una la cealaltă la o distanță de 11 cm. Spațiul dintre ele este umplut cu o soluție de NiSO4 0,34 M. Conductivitatea electrică molară a acestei soluții este de 98,7 S / cm2 / mol. Ce tensiune alternativă trebuie aplicată plăcii, astfel încât puterea curentului să fie de 0,07 A?
1. Pentru a calcula rezistența soluției, se calculează conductivitatea electrică specifică de la valorile conductivității electrice molare:
2. Calculați rezistența soluției:
3. Calculăm conform legii lui Ohm tensiunea aplicată la electrozi:
Exemplul 5.4. Conductivitatea electrică specifică a unei soluții de 0,05 M de tiocianat de amoniu este de 0,572 x 10 -2 S / cm. Calculați gradul de disociere a sării.
1. Calculam conductivitatea electrică molară prin ecuația (5.21):
2. Din manual se găsesc valorile mobilității ionilor și se calculează conform ecuației (5.25):
3. Gradul de disociere a tiocianatului de amoniu se calculează prin ecuația (5.26):
Exemplul 5.5. Conductivitatea electrică molară a soluției de acid acetic de 0,02 M este de 12,77 S cm2 / mol. Se calculează constanta de disociere și pH-ul acestei soluții.
1. Conform datelor de referință la 25 ° C, conductivitatea electrică limită molară a acidului acetic este:
2. Se calculează gradul de disociere a acidului acetic prin ecuația (5.26):
3. Se calculează constanta de disociere a acidului acetic prin ecuația (5.2):
4. Deoarece acidul acetic este un electrolit slab, concentrația de ioni de hidrogen obținut ca urmare a disocierii electrolitice a acidului va fi:
5. Calculați pH-ul soluției de acid acetic:
Electroliza este un proces în care reacțiile chimice apar sub influența unui curent electric dintr-o sursă externă, în timp ce energia electrică este transformată într-o sursă chimică. Prin electroliză, este posibil să se efectueze reacții ale căror debit spontan este imposibil.
Electroliza se efectuează în celule electrolitice (celule electrochimice) compuse din doi electrozi imersați în soluția electrolitică.
Un electrod încărcat negativ, pe care are loc procesul de reducere (atașarea electronilor), se numește catod:
Un electrod încărcat pozitiv pe care are loc procesul de oxidare (eliberarea electronilor) se numește un anod:
Ca urmare a electrolizei, electrozii sunt separați de soluția electrolitică, iar compoziția sa se schimbă în apropierea suprafeței electrozilor. Transformările chimice în timpul electrolizei depind de natura electrolitului și a solventului, de materialul electrodului și de prezența altor substanțe în soluție.
Articole similare
Trimiteți-le prietenilor: