H2SO4 este un lichid uleios incolor, densitatea unei soluții de 98% este de 1,84 g / cm, este non-volatilă și nu are miros. Extrem de higroscopic, absoarbe usor apa. În timpul dizolvării, se eliberează o cantitate mare de căldură.
Proprietăți chimice: 1. Acid puternic, se descompune în ioni în două etape aproape 100%, formează două rânduri de săruri.
HSO4 - ↔ H + + SO4 2 - sulfat ion
Acidul diluat H2S04 are toate proprietățile comune ale acizilor: modifică culoarea soluțiilor indicatorilor); interacționează cu baze, oxizi de bază și săruri (reacții de schimb de ioni, nu IRP!):
În toate aceste reacții, rolul principal este jucat de ionii de hidrogen, iar SO4 2- este pur și simplu prezent în soluție. O reacție specifică a ionului de SO4 2 (adică acidul sulfuric și toate sărurile acestuia) este reacția cu sărurile de bariu.
2H + + S04 + + Ba2 + + 2CI -> 2H + + 2CI - + BaSO4 ↓
Această reacție se numește o "reacție calitativă" la acidul sulfuric și sărurile sale, deoarece se formează un precipitat alb-cristalin fin de BaSO4. Reacția este utilizată în practica de laborator pentru a determina prezența în soluție a ionului de SO4 2.
Când interacționează cu metalele, acidul sulfuric se poate comporta diferit, în funcție de concentrația și activitatea metalului.
În H2S04 diluat, oxidantul este ionul H +. prin urmare, acidul sulfuric diluat interacționează numai cu metalele care stau într-o serie de tensiuni la hidrogen, unul dintre produsele de reacție fiind un gaz de hidrogen.
Zn 0 - 2e - → Zn + 2 H + + e - → H 0
Dar dacă luăm acid concentrat, S + 6 va acționa ca agent de oxidare. și în loc de hidrogen obținem produsul reducerii sale - un anumit compus de sulf. Ce fel? Depinde de activitatea metalului, temperatura, concentrația de acid. De obicei se formează un amestec de astfel de substanțe. Cu toate acestea, simplificarea, se poate presupune că metalul mai activ, cu atât mai adânc este procesul de recuperare, iar gradul de produs al reacției de oxidare sulf va fi mai mică. De asemenea, trebuie remarcat faptul că, cu concentrate H2 SO4 interactioneaza toate metalele cu excepția aurului și platină, dar în rece de fier, aluminiu și crom pasivizat (nu reacționează datorită formării unui film solid pe suprafața de metal), iar unele metale nu reacționează cu sulfuric diluat acid (dacă se formează în acest caz o sare insolubilă).
H2SO4 (conc.) + Ca> CaS04 + H20 + CaS Ca 0-2e -> Ca2 + S + 6 + 8e -> S2
H2 SO4 (conc.) - comburant puternic și poate oxida nu numai metale, ci și metaloizi și compușii acestora, chiar, carbonizes substanțe organice (deoarece apa colectează, de exemplu, hidrati de carbon)
C 0 - 4e - → C 4 + S + 6 + 2e - → S +4

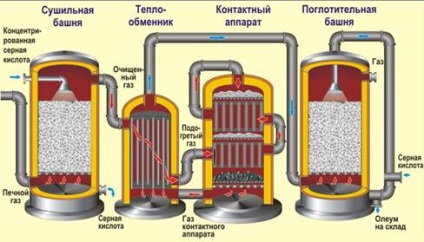
1) prăjirea piritelor (principiu de schimb de căldură, în „patul fluidizat“, aer îmbogățit cu oxigen):
2) oxidarea catalitică a dioxidului de sulf (450 ° C, V2O5 oxid de vanadiu (V), principiu contra-flux):
Produsul final este "oleum" - soluție de SO3 în H2SO4 concentrat.
În producția de acid sulfuric, dioxidul de sulf este adesea utilizat atunci când se trage minereu colorat, combustibil ars sau sulf liber. Ie Prima etapă poate fi ușor diferită, dar ultimele două sunt întotdeauna aceleași.
Aplicație. Acidul sulfuric este "pâinea" industriei chimice.
- K2SO4 și (NH4) 2SO4 - sulfații de potasiu și amoniu, în agricultură ca îngrășăminte minerale
- CuSO4 # 8729; 5H2 O - sulfat de cupru, în s / x ca mijloc de combatere a bolilor plantelor, în industria ușoară ca un colorant, în construcție ca agent antifungic în electroformarea (strat de acoperire din cupru)
FeSO4 # 8729; 7H2O - fier vitriol, în agricultură, un mijloc de combatere a dăunătorilor de plante, în industria ușoară atunci când vopselele țesături.
CaSO4 # 8729; 2H2O - gips mineral, în construcții se utilizează "gips incins" 2CaSO4 # 8729; H2O sub denumirea de "alabastru" în compoziția chitului, în medicină - matrițe, anvelope, în arta artistică și aplicată.
Na2 SO4 # 8729; 10H2O - sare Glauber, în medicină ca laxativ, în producția de sticlă
BaSO4 - în medicină, (raze X ale stomacului), în producția de hârtie, cauciuc ca umplutură
2) în metalurgia neferoasă (hidrometalurgia, producția de cupru, nichel etc.) și prelucrarea metalelor (plăci cu circuite imprimate, galvanizare, acumulatoare etc.)
3) sinteza anorganică (producția de îngrășăminte minerale, pigmenți, acizi ...) și sinteza organică (producția de coloranți, explozivi, polimeri ...)
4) producția de hârtie
5) producția de sifon (sticlă, CMC)
Sărurile de acid sulfuric nu posedă proprietăți oxidante, intră în reacțiile obișnuite de schimb de ioni.
Articole similare
Trimiteți-le prietenilor: