
Să luăm în considerare structura electronică a unui atom. Atomii constau din particule mai mici decât ele însele, numite electroni. Electronii se rotesc în jurul nucleului central. constând din unul sau mai mulți protoni și neutroni. în orbite concentrice. Electronii sunt particule încărcate negativ, protoni pozitivi și neutroni neutri.
Fiecare orbită este denumită coajă. Aceste cochilii sunt umplute succesiv din nucleu de electroni. Transferul de electroni de către organisme determină existența și transferul încărcăturii electrice.
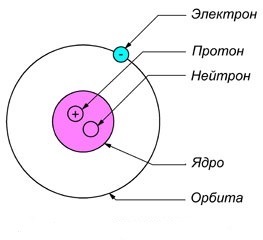
Deci, modelul structurii electronice a atomului este acesta: în centrul atomului există un nucleu încărcat pozitiv în jurul căruia se deplasează electronii încărcați negativ. Numărul de electroni din atomii de substanțe diferite este diferit.
Există un electron în atomul de hidrogen și opt în atomul de oxigen. Dar cel mai important lucru din atom nu este numărul de electroni. În atom, principalul lucru este compoziția nucleului. Electronii pot părăsi atomul și apoi dobândesc o sarcină pozitivă datorită sarcinii pozitive a nucleului. Dar proprietățile substanței nu se schimbă.
Nucleul unui atom constă din particule încărcate pozitiv. Particulele se numesc protoni. În repaus, numărul de protoni și electroni este egal, deci atomul are zero sarcină. Masa fiecarui proton este de 1840 ori mai mare decat masa oricarui electron.
Dar sarcina unui proton este egală cu magnitudinea încărcării unui electron. Experimentele au arătat că nucleul constă nu numai din protoni. De asemenea, include particule care nu au o încărcătură și sunt practic egale în masă cu protonii. Aceste particule au fost numite neutroni. Diferența în compoziția unui atom pe proton sau neutron dă atomului proprietăți foarte diferite. Acestea sunt deja substanțe diferite.
Acum, să analizăm structura coajelor de electroni ale atomilor. Cea mai exterioară cochilă se numește valență, iar numărul de electroni din el se numește valență. Mai departe de nucleul cochilismului de valență, cu atât mai mică este forța de atracție dată de fiecare electron de valență din partea nucleului. Astfel, atomul mărește posibilitatea de atașare a electronilor în cazul în care cochilia de valență nu este umplută și situată departe de nucleu sau le pierde.
Electronii din carcasa exterioară pot primi energie. Dacă electronii din cochilia de valență primesc nivelul necesar de energie din forțele externe, ei se pot îndepărta de ea și pot lăsa atomul, adică electroni liberi. Electronii liberi pot să se miște în mod arbitrar de la un atom la un atom.
Un atom poate pierde electroni fără nici un fel de deteriorare, iar apoi încărcarea devine pozitivă. Un astfel de atom este numit un ion încărcat pozitiv. Dacă un atom pierde unul sau mai mulți electroni, acesta devine un ion pozitiv, adică se încarcă pozitiv
Un atom care are același număr de electroni și protoni este neutru din punct de vedere electric. Un atom care primește unul sau mai mulți electroni devine încărcat negativ și are numele unui ion negativ.
Aceste materiale care conțin un număr mare de electroni liberi se numesc conductori.
Izolatoarele sunt opusul conductorilor. Acestea împiedică curgerea curentului electric. Izolatorii sunt stabili deoarece electronii de valență ai câtorva atomi umple vasele altor atomi prin legarea lor. Acest lucru împiedică formarea electronilor liberi.
Semiconductorii ocupă o poziție intermediară între izolatori și conductori. dar vom vorbi mai târziu despre ele.
Trimiteți-le prietenilor: