Reacțiile apar ca urmare a coliziunii directe a moleculelor. Cu toate acestea, nu toate coliziunile conduc la interacțiuni chimice. Formarea de substanțe noi este facilitată numai de molecule care au o cantitate suficientă de energie. Astfel de molecule se numesc molecule active.
Această energie minimă, suficientă pentru inițierea unei reacții chimice, se numește energia de activare și se exprimă în kcal sau kJ. Cu cât energia de activare este mai mică, cu atât reacția este mai rapidă.
În reacțiile în care energia de activare este mai mare de 150 kJ la t = 25 ° C, viteza este foarte scăzută sau practic nu apar astfel de reacții. În reacțiile în care energia de activare este mai mică de 60 kJ, rata este foarte mare (explozie).
Valoarea energiei de activare Ea depinde de natura elementelor de reacție și servește ca o caracteristică a fiecărei reacții.
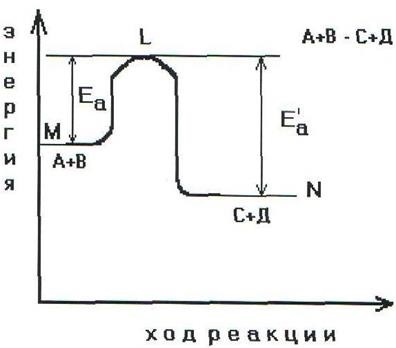
Schema energetică a reacției cu formarea
Pentru ca substanțele de reacție A și B să formeze produsele de reacție C și D, ele trebuie să depășească bariera energetică ML. Aceasta consumă energia de activare Ea. În această reacție, gruparea intermediară instabilă - complexul activat (Figura 2.6) este formată din particulele substanțelor realizatoare.
Acest complex se descompune prin formarea de produse finale, iar această cantitate de energie este eliberată, ceea ce permite produselor finale să coboare până la nivelul energiei medii a produselor finale.
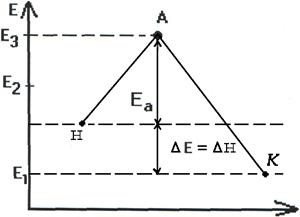
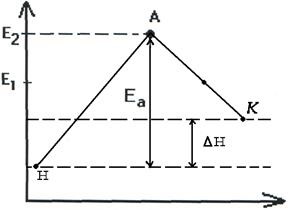
astfel schimbarea produselor poate fi exprimată sub forma schemelor de reacții endoterme și exoterme (fig.2.7, 2.8).
În mod obișnuit, reacțiile dintre substanțele cu legături covalente puternice sunt caracterizate de valori mari ale Ea și sunt lente. Acest lucru este valabil pentru multe interacțiuni, cum ar fi
a căror viteză în condiții standard este egală cu 0.
Valorile mici ale Ea și vitezele foarte mari caracterizează interacțiunile ionice în soluții
Cataliza se referă la accelerarea vitezei de reacție în prezența unor substanțe specifice, a căror cantitate nu se schimbă în timpul reacției.
Aceste substanțe accelerează doar viteza de reacție, dar nu sunt consumate ca urmare a fluxului său.
Catalizatorii pot participa la formarea produselor de reacție intermediare, dar la sfârșitul interacțiunii acestea sunt complet regenerate.
Reacțiile de încetinire sunt efectuate cu ajutorul inhibitorilor (catalizatori negativi).
- În timpul catalizei, magnitudinea efectului termic al reacției nu se schimbă.
- Dacă reacția catalizată este reversibilă, catalizatorul nu afectează echilibrul, nu modifică concentrațiile de Kp și de echilibru ale componentelor sistemului. De asemenea, accelerează reacția directă și inversă.
- Catalizatorii acționează selectiv, selectiv.
Catalizatorul, accelerând activ o interacțiune, este indiferent față de celălalt.
Din aceleași substanțe, pot fi obținute produse diferite folosind catalizatori diferiți.
Unele substanțe reduc sau distrug complet activitatea catalizatorului, se numesc otrăvuri catalitice - compuși ai arsenicului, plumbului, cianurii.
Aditivii care măresc activitatea catalizatorului sunt numiți promotori.
Activitatea, selectivitatea și durata de viață a catalizatorului depind în mare măsură de temperatura reacției catalitice.
Există catalizatori care nu au specificitate, se numesc universali. Acestea includ Nl metalice. Pt. Paladiu, care catalizează procesele de hidrogenare, oxidare. Multe procese sunt autocatalitice. În aceste reacții, catalizatorul este unul dintre produse.
Reacțiile de lanț sunt reacții chimice în care apariția unei particule active intermediar determină un număr mare (lanț) de transformări ale moleculelor originale.
Particulele libere sunt particule active, moleculele excitate sunt radicalii - particule care au un electron neparat.
Un rol important în crearea doctrinei reacțiilor în lanț au fost lucrările
NN Semenova și S. Hinshelwood, care pentru cercetarea lor în acest domeniu au primit Premiul Nobel (1956).
Reacțiile în lanț formează baza multor procese importante (cracare, polimerizare, combustie de combustibil etc.).
Există 3 tipuri de reacții în lanț:
1. Cu lanțuri fără ramuri
2. Cu lanțuri ramificate
3. Cu degenerat-ramificat
Fiecare tip de reacție include 3 etape - inițierea lanțurilor, dezvoltarea și ruperea acestora.
Procesele chimice cu lanțuri neramificate pot fi luate în considerare utilizând exemplul interacțiunii dintre hidrogen și clor:
Dacă amestecul este stocat în întuneric, atunci această reacție nu se desfășoară la temperaturi obișnuite. Pentru curgerea rapidă a acestei reacții, este suficient să se introducă în amestec o cantitate nesemnificativă de vapori metalici de sodiu.
Schema de reacție pentru etape poate fi scrisă ca:
a) inițierea lanțului
În prima etapă, în reacțiile de inițiere a lanțului (a) se formează o particulă activă, un radical liber sau un atom (C1). Rata ridicată a reacțiilor în lanț se datorează reactivității ridicate a particulelor active.
În a doua etapă a dezvoltării reacțiilor (b-d), particula activă reacționează cu molecula materiei prime pentru a forma o moleculă de produs cu o nouă particulă activă. Partea nouă regenerată reacționează din nou cu moleculă etc. Astfel, se formează un lanț neramificat
un număr mare de linkuri.
Energia de activare a interacțiunii radicalilor sau a atomilor cu molecule nu depășește 40 kJ / mol. Lungimea lanțului reacțiilor chimice elementare ajunge la 10 mii și sute de mii de legături.
În a treia etapă, lanțul este spart (d-g). Apare ca rezultat al îmbinării (recombinării) atomilor în volumul reactorului, captării de către perete, urmată de recombinarea pe pereți, formarea unui radical inactiv în interacțiunea particulelor active cu impurități (ele joacă rolul inhibitorilor).
Articole similare
-
Lucrări de cercetare pentru clasa a IV-a - influența energiei solare asupra vieții pământului
-
Malware vânătoare pro activare cod (versiunea rusă) - descărca programe pentru calculator
Trimiteți-le prietenilor: