Proprietățile tehnologice ale amoniacului.
Amoniac (NH3) - gaz incolor, cu miros înțepător și un punct de fierbere de -33.4 # 730 C și un punct de topire de -77.8 # 730; C amoniac este foarte solubil în apă (750 litri per litru de apă), puțin solubil în solvenți organici .
Când reacționează cu apă, amoniacul formează hidrați de următoarea compoziție:
O cantitate mică de molecule de amoniac dizolvate în apă ionizează ca urmare a reacției:
Gradul de disociere este 0,004.
Lichidul amoniacal dizolvă metalele alcaline și alcalino-pământoase, fosforul, sulful, iodul și mulți alți compuși anorganici și organici.
La o temperatură de 1300 ° C, amoniacul disociază în azot și hidrogen:
Amoniacul uscat formează amestecuri explozive cu aerul, limitele explozive ale cărora depind de temperatură.
Producția mondială de amoniac sa ridicat la peste 90 de milioane de tone în 1980.
Prima fabrică de producere a amoniacului a fost lansată în 1913 cu o capacitate de 25 de tone pe zi.
Materia primă în producerea de amoniac este un amestec azot-hidrogen (ABC) cu compoziția N2: H2 = 1: 3. Resursele azotului atmosferic sunt practic inepuizabile, prin urmare producția de amoniac este determinată în principal de modul de producere a hidrogenului.
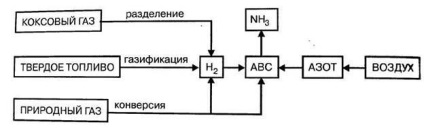
Figura 4.3. - Resursele crude de producere a amoniacului.
Azotul se obține prin rectificare (distilare) a aerului atmosferic lichefiat.
Se poate obține hidrogen pentru sinteza amoniacului:
1. separarea gazului de cocs de retur,
2. Gazeificarea combustibilului solid,
3. conversia gazelor naturale (metan sau omologii săi gazoși);
4. Conversia monoxidului de carbon în abur,
5. Cracarea metanului
6. Prin electroliză sau descompunere termică a apei
Metodele de conversie a metanului și a monoxidului de carbon, precum și separarea gazului de cocs sunt de o importanță majoră.
Pentru planurile promițătoare privind utilizarea pe scară largă a hidrogenului în scopuri industriale și energetice, se planifică producerea de pe scară largă a producției de apă - cele mai ieftine materii prime, ale căror rezerve sunt nelimitate. Metodele existente și dezvoltate pentru producerea de hidrogen din apă sunt împărțite în trei grupe:
1. electroliza apei
2. Metode termochimice
3. Metode combinate termice și electrochimice.
Electroliza - însușit metoda cea mai de producere a hidrogenului din apă, este utilizat în prezent la scară mică, în prezența electricității ieftine. Procesele electrochimice se bazează pe transformări reciproce ale energiei electrice în energie chimică și invers. Avantajele proceselor electrochimice - simplitatea lor in design hardware, proces malostadiynost, puritate ridicată a produselor care rezultă, pentru metodele chimice nadostizhimaya, etc. Principalul dezavantaj al electrolizei. - Consum de putere mare, care constituie cea mai mare parte a costurilor în costul produselor - 90%. Mai mult decât atât, în electroliza industrială a soluțiilor apoase de energie coeficient - nu mai mult de 50 - 60%, ceea ce crește și mai mult costul produselor de electroliză. La prepararea hidrogenului prin electroliza apei este folosită ca electrolit, soluțiile apoase de acizi, baze sau săruri ale acestora, ca și conductivitatea electrică a apei pure este neglijabilă - la 18 ° C, conductivitatea apei este (2-6) × 10 10 cm × m -1. Electroliții alcalini, cel mai puțin agresiv pentru materialele de construcție ale electrolizorilor, sunt cel mai adesea utilizați. Evoluția hidrogenului are loc la catod prin reacția:
Eficiența totală a producției de hidrogen prin electroliză a apei folosind electricitatea produsă de centrala nucleară nu depășește 20-30%, ceea ce afectează negativ costul hidrogenului. Reducerea costului hidrogenului electrolitic poate fi realizată prin îmbunătățirea designului celulelor, reducerea costurilor acestora și, cel mai important, prin utilizarea energiei electrice ieftine. Ca perspectivă principală, este considerată posibilitatea de a alimenta electroliza pe bază de hidrogen la energia "eșuată" a centralelor nucleare, adică utilizarea energiei electrice în acele perioade în care stațiile sunt încărcate, de exemplu, noaptea.
Metoda termochemică de producere a hidrogenului se bazează pe descompunerea apei cu ajutorul energiei termice, care se presupune că se obține din reactoarele atomice cu răcire cu heliu, folosind căldura lichidului de răcire la ieșirea din reactor. Descompunerea directă a apei prin reacție
irealizabilă, deoarece este necesar pentru această temperatură ridicată (aproximativ 1000 ° C), reacția constanta de echilibru este foarte mic (10 -6). Implementarea procesului este posibilă prin înlocuirea reacția directă a descompunerii apei ciclu termochimică constând din mai multe etape, fiecare dintre acestea echilibru valori constante sunt acceptabile în practică. Dezvoltarea si a propus multe ciclu termochimic pentru descompunerea apei la temperaturi disponibile în ceea ce privește utilizarea căldurii din gazele de răcire ale reactoarelor nucleare. Cele mai multe dintre intermediari au o afinitate ridicată la hidrogen sau la cicluri de oxigen propuse - este halogen, elemente de grupa IV (sulf), grupa II metale (Mg, Ca. Ba), și elemente de tranziție cu stare de oxidare variabilă (V, Fe). Mai jos este un exemplu de ciclu termochimic de reacții care conduce la descompunerea apei în H2 și O2:
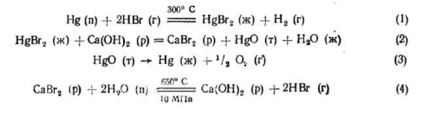
Întregul ciclu termochemic al descompunerii apei este un ciclu închis, deoarece toți reactivii inițiali sunt separați de produsele de reacție și returnați la ciclu, cu excepția apei consumate pentru formarea de hidrogen și oxigen. Temperatura maximă de reacție nu depășește 700 ° C și poate fi prevăzută cu un agent de răcire la ieșirea reactorului nuclear la un nivel de 800-900 ° C.
În prezent, niciuna dintre ciclurile termochimice propuse nu a fost încă pusă în aplicare în industrie, iar valoarea eficienței ciclurilor, precum și calculele costurilor de obținere a hidrogenului prin această metodă nu au fost încă determinate.
Metoda combinată de producere a hidrogenului constă în combinarea etapelor termo-electrochimice ale procesului. Avantajele preconizate constau metoda combinată, care poate fi utilizată meritele fiecare dintre metodele de mai sus: electrochimică bine dezvoltate, are un design simplu hardware și termochimic mai economic, dar puțin stăpânit și cuprinde etapele care sunt dificil pentru implementare comercială.
Un exemplu este ciclul combinat cu acid sulfuric pentru producerea de hidrogen și oxigen din apă. Acesta este un proces în două etape, care cuprinde două etape
1. reacție termochimică - endotermă, efectuată la 900 ° C
2. proces electrochimic la temperatură joasă:
Reacția din urmă poate fi realizată numai prin electroliză, deoarece constanta de echilibru și randamentul teoretic al hidrogenului sunt extrem de mici. Sursa de energie pentru o instalație combinată poate fi un reactor de gaze atomice care alimentează stadiul termochemic eliminat termic și electricitatea cu o etapă electrochimică. Costurile estimate pentru o instalație combinată sunt mai mici decât pentru electroliza directă a apei. Eficiența globală a procesului ar trebui să fie de 35 - 37%. Potrivit experților, combinația de etape termochimice și electrochimice reprezintă direcția cea mai promițătoare pentru producerea pe scară largă a hidrogenului din apă.
Principala metodă de obținere a hidrogenului pentru sinteza amoniacului este conversia catalitică a metanului. Materia primă pentru această metodă este gazul natural și asociat. conținând până la 90-98% metan.
Articole similare
Trimiteți-le prietenilor: