Scop: să ia în considerare metodele de stocare a culturii celulare, avantajele crioconservării celulelor vegetale, etapele principale, precum și dificultățile care apar în legătură cu caracteristicile celulelor de plante.
1. Întârzierea creșterii celulare
2. Principalele etape de crioconservare
2.1 Pregătirea culturii
2.2. Înghețarea și depozitarea
2.3 Înghețarea și îndepărtarea crisoprotectantului
2.4 Recultivarea celulelor și evaluarea acestora după crioconservare
1 În prezent, crearea de noi soiuri de plante și schimbarea periodică, care se datorează, în primul rând, cu pierderea de varietate de simptome, apariția unor noi dăunători fund-lyatsy și boli, schimbările climatice, SMO-vă și o varietate de alte motive. Durata medie de viață a grâului și a altor boabe este de obicei de 5-10 ani. Pentru a obține noi soiuri și a le îmbunătăți pe cele vechi, este nevoie de un material genetic divers. Pentru a păstra fondul genetic al speciilor rare și pe cale de dispariție, prețul-TION de site-uri de reproducere și tulpini - producători de materiale importante-TION dezvoltate economic metode pentru crearea de colecții și în bănci de gene in vitro.
Principala sursă de gene sunt semințele. Pentru a crea noi linii celulare. sintetizând produse valoroase, este necesar să se păstreze o colecție de celule, adică standardele celulelor producătorilor care au anumite caracteristici. Pentru a studia procesele fiziologice și biochimice în celulele culturale, devine necesară conservarea liniilor de celule standard originale pentru o lungă perioadă de timp. Astfel, pentru a rezolva problemele, sunt necesare metode de stocare a culturii celulare. Există două abordări pentru a rezolva această problemă: încetinirea creșterii celulelor și stocarea într-o stare înghețată, adică crioconservarea (din khyos greacă - "îngheț", "gheață"). Provocarea este de a schimba cinetica creșterii culturii și de a mări timpul dintre transplanturi. Acest lucru ar permite transplantarea culturilor o dată la fiecare 3-4 luni, un an și chiar mai puține ori. În prezent, încetinirea creșterii datorită factorilor care limitează creșterea a fost obținută numai pentru plantele de lăstari și regenerare.
Cea mai eficientă modalitate de a încetini creșterea este reducerea temperaturii cultivării în combinație cu iluminarea redusă. Alegerea temperaturii este determinată de rezistența la frig a speciilor de plante. Astfel, pentru colectarea colecțiilor de cartofi, a fost utilizată o temperatură de 10 ° C și merișoarele de 1 ° C. Se recomandă culturilor să crească în mod normal la 20 - 25 ° C, să folosească 4-10 ° C.
Creșterea plantelor poate încetini, de asemenea, adăugarea la nutrienți CFE de osmotikov - manitol și sorbitol, concentrația de zaharoză a crescut sau introducerea în mediul de cultură a substanțelor care inhibă creșterea. In ultimii kaches-TBE au fost utilizate hidrazida acidului maleic, 2,2 - metilgidrazid hlorholinhlorida acid succinic, abscisic acru-ta. În cazuri foarte rare, reducerea conținutului de oxigen - hipoxia - este utilizată pentru a încetini creșterea. Condițiile de hipoxie sunt create prin aplicarea unui amestec de azot 90% și oxigen 10%. Uneori concentrația de oxigen este redusă și, în același timp, presiunea atmosferică este redusă. Pentru a evita epuizarea nutrienților și deshidratarea, volumul mediu de agar pentru culturile cu creștere lentă este crescut. Dacă se folosește un mediu de cultură lichid, acesta este suplimentat din când în când, deoarece se evaporă mai activ.
Crioconservare 2 - o adâncime de congelare și depozitare la temperaturi foarte scăzute, de exemplu la temperatura azotului lichid (-196 ° C). O astfel de temperatură garantează conservarea stabilă a caracteristicilor genetice ale obiectelor practic pentru orice perioadă. Această metodă vă permite să stocați cel mai divers material - de la protoplaste izolate la embrioni și semințe. În prezent, înghețarea profundă a celulelor, țesuturilor și organelor a devenit răspândită în medicină și în creșterea animalelor. Situația este diferită de materialul vegetal. Principalele dificultăți sunt legate de specificitatea celulelor de plante și de procesul de înghețare profundă. Celulele de plante care sunt vacuole mari, mari și o mulțime de apă sunt mai afectate atunci când sunt congelate și ulterior dezghețate. Deteriorarea celulelor este asociată cu formarea de gheață atât în interiorul celulelor cât și în afara ușilor. De obicei, gheața se formează mai întâi într-o soluție externă din jurul celulelor. citoplasmă punct de minus 1 ° C congelare, dar celulele nu sunt contorizarea-zshimi la aproximativ 10-15 C, deoarece până la această plasmalemei previne pătrunderea în continuare a cristalelor de gheață în creștere în soluția externă. Creșterea cristalelor de gheață din interiorul celulei îi distruge membranele.
Dacă temperatura scade încet, celula reușește să piardă o parte din apa liberă care o părăsește și îngheață pe suprafața cristalelor care cresc lent în soluția externă. O înghețare foarte rapidă nu este însoțită de deshidratare și duce la apariția cristalelor de gheață în citoplasmă. Încălzirea îngustă poate elimina complet cristalizarea apei din celulă, dar în mod inevitabil există o deshidratare și o comprimare semnificativă a protoplaziei. Deshidratarea celulei se datorează concentrației soluției externe datorită formării gheții în ea. Excesul de liză în plasmă și stresul osmotic cauzat de acesta (în special cu deplasmoliză ulterioară) conduce celula la moarte.
Astfel, cauza morții celulei în timpul congelării este formarea gheții intracelulare și deteriorarea mecanică a membranei și stres osmotic cauzată de un puternic celule de deshidratare. În consecință, toate tehnicile utilizate în crioconservarea vizează un anumit echilibru al ambelor factori dăunători. Supraviețuirea celulelor de plante depinde de o serie de condiții: gena de vedere genetic și caracteristicile lor morfologice și fiziologice și capacitatea de holo-dovomu călire, compoziția și cantitatea de cryoprotectants naturale sau adăugate artificial, nivelul de permeabilitate al acestor substanțe și rata de reducere a temperaturii apei și condițiile de decongelare.
Lucrarea privind depozitarea în crios a culturii celulare constă în următoarele etape (Fig.18): - prepararea culturii celulare,
- depozitarea în azot lichid,
- recultivarea și regenerarea plantelor.
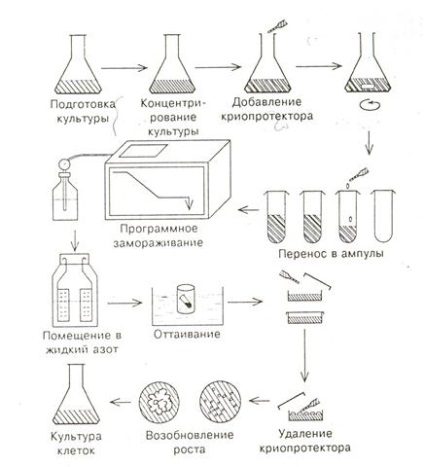
Figura 18. Etapele crioconservării culturii celulare
2.1 Să ne concentram asupra principalelor etape ale criocrezervării celulelor. Sa demonstrat experimental posibilitatea stocării la temperaturi ultraviolete ale celulelor cultivate, meristeme izolate, vârfuri de lăstari, embrioni, polen. Cu toate acestea, pentru crioconservarea unor astfel de obiecte diferite, desigur, sunt necesare diferite abordări și condiții încă de la începutul lucrării. Metodele de crioprezervare sunt cel mai bine dezvoltate pentru culturile de suspensie. Mărimea celulelor meristemoide este mai rezistentă la îngheț decât celulele mari vacuolete. Același lucru se aplică suspensiilor fin dispersate cu agregate libere de celule în comparație cu masele mari de celule dense. Celulele speciilor de plante tropicale pot fi mai puțin rezistente decât celulele de plante din zona temperată. Pentru structuri mai complexe, cum ar fi meristemele, embrionii, embrionii, este necesară optimizarea condițiilor fiecărei etape. O importanță deosebită este pregătirea specială a culturii, al cărei scop este îmbogățirea celulelor de tip meristematic. Cultivarea prelungită în osmotică, sincronizarea diviziunii celulare, reducerea timpului de transplantare promovează reducerea dimensiunii celulare și sporește supraviețuirea. Pentru culturi individuale, un efect pozitiv asupra viabilității
Cultivarea cu unii aminoacizi, datorită creșterii nivelului zaharurilor endogene din celule. Pentru culturile de suspensie, concentrația este un moment important de pregătire.
2.2 Crioprotectorii sunt substanțe care reduc punctul de contaminare, leagă apa intracelulară și protejează celulele de stresul mecanic și osmotic. Acestea includ dimetil sulfoxid (DMSO), glicerol, prolină și zaharoză, care este un crioprotector natural pentru plante. Crioprotectorii înșiși pot provoca, de asemenea, stres osmotic, astfel încât să fie selectate concentrațiile și combinațiile optime ale acestora.
DMSO are o capacitate unică de penetrare, acest lucru fiind important în special pentru structurile mari, dense, organizate, de exemplu, meteoriți. Pentru ei, faza de preparare este în principal în pre-cultivare cu DMSO 5% adăugată în mediu. Acest lucru asigură crearea de concentrații criprotective eficiente în apex, dimensiunea cărora este de aproximativ 0,3-0,5 mm.
Împreună cu alegerea crioprotectorilor, și este pentru aceste celule, este foarte important să găsim programul optim de înghețare. Există înghețarea lentă, treptată, rapidă și super-rapidă trei. Cu o înghețare lentă graduală, temperatura în intervalul de la 0 ° la -40 ° scade cu o rată de 0,5 până la 1 ° pe minut. Cu înghețarea rapidă, obiectul din fiolă cu crioprotector este imersat imediat în azot lichid. Cu înghețarea ultra rapidă, obiectul în sine este introdus direct în azot lichid. Polenul poate fi înghețat în formă uscată, sigilat în fiole speciale de plastic, prin imersarea în azot lichid. Datele obținute de crio-banca din IGF de la Moscova: arată că înghețarea programatică dă rezultate mai reușite. Acest lucru necesită construcții speciale cu o cameră de lucru care este răcită la o viteză programată prin introducerea de vapori de azot lichid.
2.3 Dezghețarea și restabilirea creșterii culturilor sunt etape critice și adesea critice ale procesului. Dacă celulele sunt dezghețate prea lent, acestea vor re-forma gheață, care are un efect dăunător. Înghețarea rapidă împiedică acest lucru. Decongelarea se face prin imersarea fiolelor într-o baie caldă (+ 40 о С) sau prin picurarea apei calde sau a unui mediu de cultură pe obiecte înghețate. Cu toate acestea, în cazuri excepționale, dezghețarea lentă este mai potrivită.
După dezghețare, se îndepărtează crioprotectantul, care se face, de obicei, la rece. Majoritatea schimbărilor fizice ale celulelor apar în timpul înghețării și dezghețării, dar celulele nou dezghețate sunt puternic predispuse la deteriorare și, prin urmare, necesită îngrijire medicală atentă. Aceasta începe cu transplantarea directă a celulei în mediul de restaurare fără spălare cu conservarea crioprotectorilor din celule. Adesea, crioprotectorul este îndepărtat prin condiții speciale de spălare.
2.4 Starea culturilor este foarte dificil de evaluat atunci când materialul este conservat la rece. Evaluarea se efectuează după decongelare și este necesară pentru utilizarea culturilor. Pentru evaluarea rapidă a culturilor, cea mai potrivită
viabilitate. Este de dorit ca testele să fie efectuate imediat după decongelare și a doua zi. Testele sunt efectuate periodic în timpul reluării creșterii pentru a monitoriza creșterea conținutului de celule viabile din viața sau țesuturi vii.
Pentru probele vizibile sub microscop în lumină transmisă, adică suspensii celulare, protoplaști, calusuri mici și structuri organizate, colorarea cu diacetat de fluoresceină, se utilizează fenosfranină. Sărurile de tetrazolium sunt folosite pentru structurile de tip calli și dense, cu structuri mari.
Evaluarea cantitativă a supraviețuirii este creșterea. Studiați creșterea celulelor de cultură utilizând orice metode standard pentru măsurarea creșterii, inclusiv creșterea masei brute și uscate, volumul celulelor sedimentate, densitatea optică a celulelor, observarea directă microscopică. Metodele citologice standard permit evaluarea gradului de deteriorare și a proceselor de recuperare în țesuturi. Chiar și date mai precise sunt obținute prin studierea ultrastructurii într-un microscop electronic.
Având în vedere eterogenitatea culturilor celulare, pregătirea lor pentru îngheț, este imposibil să se excludă complet posibilitatea de a prezenta avantaje selective pentru orice subpopulație, în special cu supraviețuirea scăzută după dezghețare. Prin urmare, sunt necesare teste genetice, fiziologice și biochimice.
În stadiul de recultivare, uneori cunoscute metode de intensificare a creșterii celulare sunt folosite pentru a evita selectarea unor celule mutante rezistente la frig. S-a stabilit că depozitarea în azot lichid nu afectează supraviețuirea și reînnoirea culturilor celulare. Recuperate după depozitare în azot lichid, culturile celulare sunt identice cu cele originale și sunt potrivite pentru aplicații biotehnologice.
Astfel, cribonul celulelor, meristemurilor, polenului asigură conservarea genei nu numai a tulpinilor cultivate in vitro cultivate, ci și a speciilor rare și pe cale de dispariție, care este deosebit de importantă pentru plantele cu răspândire vegetativă.
1. Metode de conservare a genei in vitro.
2. Care este avantajul criocrezervării celulelor?
3. Ce este un crioprotector?
4. Prepararea celulei pentru crioconservare.
5. Cum celulele se îngheață și se topesc?
Lista literaturii utilizate
5. Kalinin F.L. Sarnatskaya V.V. Polishchuk V.V. Metode de cultură
țesuturi și celule în fiziologia și biochimia plantelor. -Kiv: Naukova Dumka,
1980.
6. Valikhanova G.Zh. Rakhimbaev I.R. Karzhasova A.V. Bishimbayeva N.K.
Ghid metodic pentru lecțiile practice privind cultura țesuturilor
plante. -Alma-Ata: KazGU, 1983.
7. Kataeva P.V. Butenko R.G. Micropropagarea clonică a plantelor.
M. Nauka, 1983.
8.Gleba Yu.Yu. Sytin către KM Ingineria celulară a plantelor. -KIEV:
Naukova Dumka, 1984.
9.Butenko R.G. Cultura celulelor vegetale și biotehnologiei. -M: Știință,
1986.
10. Inginerie celulară / Butenko RG Gusev MB. Kirkin A.F.
Biotechnology, T. 3.-M .; Liceul, 1987.
11. Biotehnologia plantelor: cultura celulară. - M;
Agropromizdat, 1989.
Mamyrbekova Aigul Kumekbaevna, Abubakirova Azhar Abdugapparovna
Articole similare
Trimiteți-le prietenilor: