Amoniac, NH3. cea mai simplă legătură chimică dintre azot și hidrogen. Unul dintre cele mai importante produse ale industriei chimice; sinteza amoniacului din aerul de azot și hidrogen - principala metodă de obținere a așa-numitei. legat de azot. În natură, amoniacul este format prin descompunerea substanțelor organice care conțin azot. Numele "amoniac" - scurtat de greacă. hals ammoniakos sau lat. Amoniac salicilic; numita amoniac (clorura de amoniu), care a fost primită în oaza de amoniu (acum Siva) în deșertul libian.
Proprietăți fizice și chimice. Amoniacul este un gaz incolor, cu un miros ascuțit și un gust acru. Densitatea de amoniac gazos la 0 ° C și 101,3 kN / m 2 (760 mm Hg. V.) 0.7714 kg / m 3. Punctul de fierbere -33.35 ° C -77.70 ° C, punct de topire 132 tkpit 4 ° C, presiunea critică de 11,28 MN / m 2 (115.0 kg / cm2), densitatea critică 235 kg / m 3. căldura de vaporizare a 23,37 kJ / mol (5.581 kcal / mol). Un amestec uscat de amoniac și aer este capabil să explodeze; Limitele explozivității la temperatura camerei se situează în intervalul de 15,5-28% amoniac. Cu o temperatură în creștere, granițele se extind. Amoniacul este foarte solubil în apă (la 0 ° C absoarbe volumul de apă de aproximativ 1200 de volume de amoniac la 20 ° C. - 700 de volume de amoniac). La 20 ° C și 0,87 MN / m 2 (8,9 kgf / cm2) se transformă rapid în amoniac, lichid incolor, cu o densitate de 681.4 kg / m 3. lumina refracta puternic. Ca apa. amoniacul lichid este puternic asociat, în principal datorită formării legăturilor de hidrogen. Amoniacul lichid practic nu conduce un curent electric. Amoniacul lichid este un solvent bun pentru un număr foarte mare de organici, precum și pentru mulți compuși anorganici. Amoniacul solid - cristale cubice incolore.
Molecula de amoniac are forma unei piramide trigonometrice regulate cu un atom de N la vârf; unghiuri între legăturile H-N-H 108 °, distanțele interatomice H-N-H 1,015, H-H 1,64.
O proprietate interesantă a moleculelor de amoniac este capacitatea lor de inversare structurală. adică "a se întoarce spre interior" prin trecerea unui atom de azot prin planul bazei piramidei formate de atomii de hidrogen. Inversiunea este asociată cu radiații cu o frecvență strict definită, pe baza căreia a fost creat echipamentul pentru determinarea timpului foarte precis (generatori moleculari). Astfel de "ceasuri moleculare" au permis, în special, să se stabilească că durata zilelor terestre crește cu 0,43 msec anual. Momentul dipol al moleculei de amoniac este 1,43D. Datorită absenței electronilor neparticipați, amoniacul este diamagnetic.
Recepție și aplicare. În condiții de laborator, amoniacul poate fi preparat prin înlocuirea sărurilor sale puternice baze de amoniu în conformitate cu schema: 2NH4 CI + Ca (OH) 2 = 2NH3 + CaCl2 + 2H2 O. Cel mai vechi proces industrial pentru producerea de amoniac - separarea acestuia din gazele de ardere la cocsificarea cărbunelui. Principala metodă modernă de producere a amoniacului industrial este sinteza de la elemente - azot și hidrogen. propusă în 1908 de către chimistul german F. Haber.
Cea mai obișnuită și mai economică metodă de obținere a gazului de proces pentru sinteza amoniacului este conversia gazelor de hidrocarburi. Materia primă în acest proces este gazul natural. precum și a gazelor petroliere asociate. gaze de rafinare. gaze reziduale rezultate din producția de acetilenă. Metoda de conversie REZUMAT pentru producerea amestecului de azot-hidrogen este la descompunerea la temperatură ridicată metan și omologii acestuia în hidrogen și monoxid de carbon folosind oxidanți - vapori de apă și oxigen. Aerul sau aerul atmosferic se adaugă la gazul convertit. îmbogățit cu oxigen. Sinteza amoniacului din substanțe simple
curge cu eliberarea căldurii și o scădere a volumului. Cel mai favorabil, în termeni de echilibru. condițiile de formare a amoniacului sunt posibil temperatura mai scăzută și posibil presiunea mai mare. Fără catalizatori, reacția de sinteză a amoniacului nu apare deloc. În industrie, pentru sinteza amoniacului se utilizează numai catalizatori de fier. obținută prin reducerea oxidului de fier topit Fe3O4 cu activatori (Al2O3, K2O, CaO, SiO2, și uneori MgO). O etapă importantă în procesul de sinteză - curățare amestec gazos de otrăvuri (acestea includ substanțe care conțin S, O2 Se, P, Ca, CO, vapori de apă, etc .....).
Metodele de producere a amoniacului sintetic diferă în presiunea aplicată. sistem scazut (10-15 MN / m 2), mediu (25-30 MN / m 2) si presiune mare (50-100 Mk / L 2). Cel mai comun sistem de presiune medie (30 MN / m2 și 500 ° C) (1 MN / m 2 (10 kgf / cm2) pentru a crește gradul de utilizare a gazelor în sistemele moderne de sinteză a amoniacului utilizate circulație multiplă a amestecului azot-hidrogen. - amoniacal circular ciclu (vezi figura).
Gaz gazos (amestec azot-hidrogen) și nereacționat, așa-numitul. gazele care circulă intră mai întâi în filtru 1, în cazul în care acestea sunt curățate de impurități, apoi în spațiul inelar al coloanei de condensare 2, dând înapoi căldura la gaz. se deplasează de-a lungul tuburilor coloanei. Apoi, gazele trec prin vaporizatorul 3, în care are loc răcirea și condensarea amoniacului. îndepărtat de gazele circulante. Amestecul răcit a fost condensat gaze și amoniac din vaporizator sunt direcționate într-o coloană de condensare parte de separare (separator), în care amoniacul lichid este separat, și ca produs finit este evacuat printr-o conductă în rezervorul 9. amoniac gazos. lăsând evaporatorul. trece trap lichid 4, amoniacul este eliberat din picăturile de lichid, și este trimis la instalația de prelucrare sau într-o unitate de refrigerare pentru lichefiere. Gaza. scutit de amoniac. din separator intră în coloana de sinteză 5. Coloana de sinteză din interior are o cutie de catalizator cu o duză tubulară sau de raft și un schimbător de căldură. Gaza. care trec prin coloana de sinteză, reacționează una cu cealaltă; Amestecul de gaze care iese din coloană conține 15-20% amoniac. Mai mult, aceste gaze intră în condensatorul 6, unde amoniacul lichefiază amoniacul lichid este separat în separatorul 7 și este alimentat în rezervorul 9, iar gazul nereacționat circulă pompa 8 în filtrul 1 pentru amestecarea cu un amestec de azot-hidrogen proaspăt.
Amoniacul este utilizat pentru a produce acid azotic. săruri care conțin azot. uree. acidul prusic. soda prin metoda amoniacului. Deoarece amoniacul lichid are o căldură de evaporare ridicată. atunci. serveste ca o substanta de lucru a masinilor de refrigerare. Amoniacul lichid și soluțiile sale apoase sunt utilizate ca îngrășăminte lichide. Cantități mari de amoniac sunt utilizate pentru amoniacarea amestecurilor de superfosfați și grăsimi.
Amoniacul este toxic. Se irită puternic membranele mucoase. Atacurile acute cu amoniac provoacă leziuni ale ochilor și ale tractului respirator, scurtarea respirației, inflamarea plămânilor. Concentrația maximă admisă de amoniac în aerul clădirilor industriale este de 0,02 g / m 3. Amoniacul este depozitat în butelii din oțel. pictat în galben, cu o inscripție neagră - amoniac.
Lit. Tehnologia azotului legat. M. 1966.
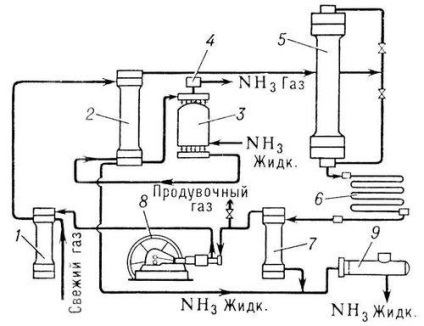
Unitatea de sinteză a amoniacului (diagrama fluxului de proces).

Articole similare
-
Contul deschis - enciclopedii mari de petrol și gaze, articol, pagina 1
-
Umiditate - o granulă - marile enciclopedii de petrol și gaze, articol, pagina 3
Trimiteți-le prietenilor: