Sarcina 1.
O soluție care conține 34 grame de amestec de hidroxid de potasiu și hidroxid de sodiu a fost neutralizată cu exces de acid clorhidric. Ca rezultat, s-au format 47,9 g de săruri. Determinați masa fiecărui hidroxid din amestecul de alimentare.
având în vedere:
masa amestecului de hidroxizi în p-re: m inițial (KOH + NaOH) = 34 g;
masa de săruri după neutralizarea soluției: un amestec de săruri = 47,9 g.
Caută:
masă de hidroxid de potasiu în amestecul de pornire: m (KOH) =?
masă de hidroxid de sodiu în amestecul de pornire: m (NaOH) = -
soluţie:
Ambele componente ale amestecului (KOH și NaOH) interacționează simultan cu acidul clorhidric. Se înregistrează pentru fiecare dintre substanțele amestecului reacția chimică:
KOH + HCI = KC1 + H20
NaOH + HCI = NaCI + H20
Rezolvați această problemă prin aplicarea unui algoritm contra. Acesta poate fi reprezentat după cum urmează:
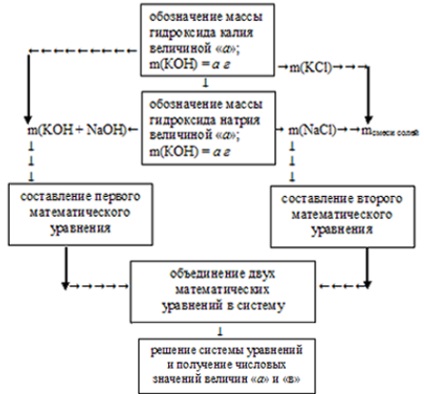
În condiție, este necesar să se determine masa fiecăruia dintre hidroxizi, așa că vom indica masa KOH cu cantitatea "a" și masa NaOH în valoarea "in".
1. Folosind valorile introduse, vom compila prima ecuatie matematica. Pentru aceasta, echivalăm suma masei de hidroxizi la masa lor totală în soluția inițială:
a + b = m (KOH + NaOH) = 34 g,
a + b = 34.
A fost obținută o ecuație matematică cu două necunoscute.
2. Acum, folosind valorile "a" și "b" după cum se știe, prin ecuațiile reacțiilor de neutralizare, determinăm masele sărurilor obținute:
Formăm proporția:
și r KOH dau x, KCI (prin ipoteză)
56 g de KOH dau 74,5 g de KC1 (prin ecuația)
Formăm proporția:
în g NaOH dau x N NaCI (prin ipoteză)
40 g de NaOH dau 58,5 g de NaCI (prin ecuația)
3. Se cunoaște din condiția că masa totală a sărurilor obținute este de 47,9 g. Folosind valorile obținute în etapa anterioară, compunem a doua ecuație matematică cu două necunoscute:
4. Am combinat două ecuații matematice în sistem:
Soluția acestui sistem de ecuații dă următoarele valori:
a = 13,4 g; c = 20,6 g.
Valoarea lui "a" reprezintă masa KOH, prin urmare:
valoarea "in" am indicat masa de NaOH, prin urmare:
Răspuns: m (KOH) = 13,4 g; m (NaOH) = 20,6 g.
Sarcina 2.
92 g dintr-un amestec de carbonat de calciu și azotat de calciu anhidru a fost calcinat până la sfârșitul evoluției gazului. Ca urmare, a fost eliberat un amestec de gaze cu o densitate relativă de hidrogen 21,63. Se determină masa fiecărei sare din amestecul inițial.
având în vedere:
masa amestecului de sare: amestec [CaC03] + Ca (NO3) 2] = 92 g;
densitatea relativă a amestecului de gaze în hidrogen: D (H2) = 21,63.
Caută:
masa de carbonat de calciu în amestecul inițial: m (CaCO3) =?
masa azotatului de calciu în amestecul inițial: m [Ca (NO3) 2] =?
soluţie:
Reținem reacțiile de descompunere ale fiecărei săruri:
Pentru ao rezolva, trebuie să utilizați algoritmul contor:
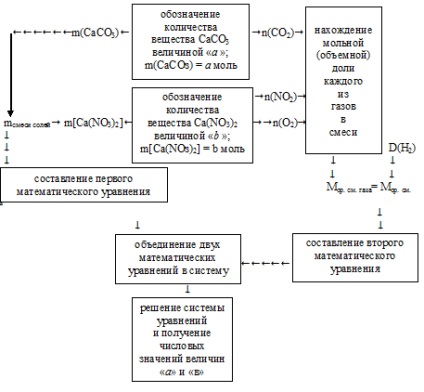
Aplicăm algoritmul prezentat.
1. Cantitățile necesare sunt masele de săruri din amestecul inițial. Pentru o mai mare ușurință a calculelor suplimentare, este mai rezonabil să se utilizeze valoarea "a" pentru a indica cantitatea de substanță (n, mol) de carbonat de calciu: n (CaCO3) = o mol.
Cantitatea "b" reprezintă cantitatea de substanță (n, mol) de azotat de calciu: n [Ca (NO3) 2] = b mol.
În consecință, prin masele moleculare ale acestor săruri se poate proceda la masele de săruri:
2. Masa totală a sărurilor inițiale este indicată în stare. Acest lucru ne permite să compilam prima ecuație matematică cu două necunoscute:
3. În plus, folosind valorile introduse "a" și "c", din ecuațiile reacțiilor de descompunere, determinăm cantitatea de substanță a fiecăruia dintre gaze:
n = un mol n = x mol
CaCO3 = CaO + CO2 ↑
n = 1 mol n = 1 molar
Să compunem proporția:
și un mol de CaCO3 dă x mol de CO2 (în funcție de condiție)
1 mol de CaCO3 dau 1 mol de CO2 (prin ecuația)
Să facem proporțiile:
b mol de Ca (N03) 2 dau x mol de NO2 (conform condiției)
2 moli de Ca (NO3) 2 dau 4 moli de NO2 (prin ecuația)
b mol de Ca (NO3) 2 dau un mol de O2 (conform condiției)
2 moli de Ca (N03) 2 dau 1 mol de O2 (prin ecuația)
4. Se determină fracția molară a fiecăruia dintre gazele din amestec (în fracțiuni ale unuia).
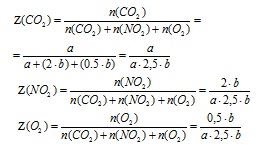
5. Se determină masa molară medie a amestecului de gaze din valorile fracțiilor molare ale acestora în amestec.
Conform legii lui Avagadro, fracția molară de gaz din amestec este numeric egală cu fracția de volum (numai pentru gaze), deci în formula pentru determinarea Mn. în loc de fracțiunea de volum (Z) pe care o înlocuim
valoarea fracției moleculare () a gazului corespunzător.
6. Se determină masa molară medie a amestecului de gaze din datele de densitate relativă.
7. Ecuația expresiilor Msp. amestecurile de gaze obținute în cele două acțiuni anterioare, compunem a doua ecuație matematică:
8. Unificăm ecuațiile obținute în a doua și a șaptea acțiune în sistem
Când se rezolvă, valorile sunt: a = 0,1; b = 0,5.
Cantitățile "a" și "b" reprezintă cantitatea de substanță CaCO3 și Ca (NO3) 2 din amestecul inițial de săruri, prin urmare:
9. Se determină masa sărurilor din amestecul inițial:
- Sunteți aici:
- principal
- sarcini
- EGE-chimie
- Separarea selectivă a amestecurilor Sarcina 1
Articole similare
Trimiteți-le prietenilor: