1.3. Proprietăți chimice
1.4. Izomerism optic
2.2. Legarea peptidelor
Definiție: Compuși organici care conțin carboxil și grupe amino în moleculă se numesc aminoacizi. Dintre resturile de aminoacizi, sunt construite proteinele - principalul material din care sunt compuse obiectele de natură vii. Prin urmare, aminoacizii au o mare importanță.
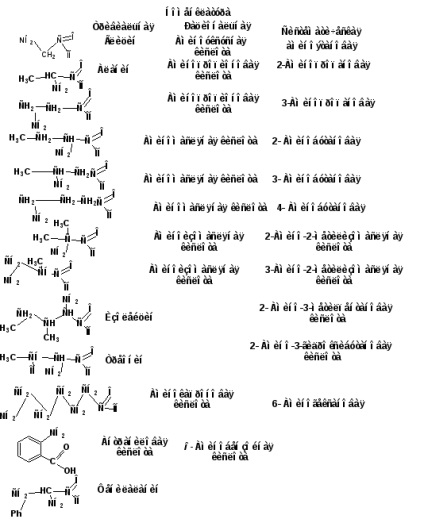
1.1. Clasificare, nomenclatură, izomerism.
26 de a-aminoacizi, din care sunt construiți proteinele, au propriile lor nume. De exemplu: glicină, alanină, valină, serină etc. nomenclatură rațională se bazează pe numele triviale ale acidului carboxilic este plasat în prefixul „amino“ și notat cu litera poziției hidroxi alfabetul grecesc. Conform nomenclaturii sistematice, locatorul desemnează poziția grupării amino. Grupul carboxil ocupă întotdeauna prima poziție. Titlu construit din hidrocarburi suplimentat cu prefixul „amino“ și sufixul „oic“ sau „diovaya“.
seria omoloagă începe cu aminomuravinoy amino monocarboxilici sau amidă parțială a acidului carbonic. Apoi vine glicina sau aminoaceticul, Acești doi acizi nu au izomeri structurali. Izomerismul aminoacizilor este legat de poziția grupării amino și de structura scheletului de carbon. Prin urmare, următorii acizi carboxilici - propionic - molgut fi doi izomeri care diferă în poziția grupării amino: acid propionic α-amino și acid propionic β- Mino. Un acid cu patru atomi de carbon poate exista sub forma a cinci izomeri. Trei corespund acidului n-butiric și a două acid izobutiric.
Toți aminoacizii naturali, cu excepția aminoaceticului, conțin un atom de carbon asimetric. Toți aparțin seriei L.
1.2. Metode de obținere
Acțiunea amoniacului asupra acizilor a-halocarboxilici:
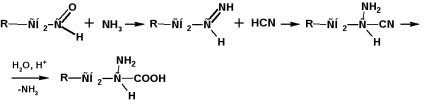
Pregătirea prin metoda Strecker-Zelinsky
Prin această metodă, aldehida este tratată cu o soluție apoasă dintr-un amestec de cianură de potasiu și clorură de amoniu:
Adăugarea amoniacului la acizii a, p-nesaturați:
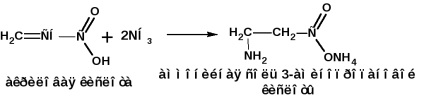
Primirea prin metoda Rodionov:
Metode de producere a altor aminoacizi
Prepararea y-aminoacidului din acid levulinic:
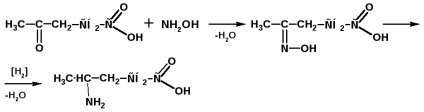
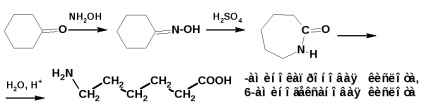
Aminoacizii cu mai multe grupuri funcționale unul de celălalt se obțin prin rearanjare Beckmann. De exemplu, prepararea caprolactamului și a-aminoacidului (acidul u-caproic):
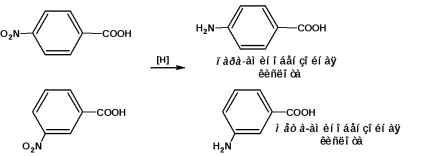
para-și acizi meta-aminobenzoici sunt obținuți prin reducerea acizilor nitrobenzoici corespunzători:
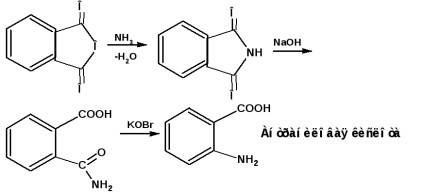
orto izomer. așa-numitul acid antranilic este obținut din anhidrida ftalică, prin ftalimidă prin acțiunea hipromiților:
1.3. Proprietăți chimice
Aminoacizii sunt substanțe cristaline incolore, cu puncte de topire ridicate, care diferă puțin pentru aminoacizii diferiți și, prin urmare, nu sunt caracteristice. Topirea este însoțită de descompunerea substanței. Topirea cu descompunere este caracteristică sărurilor. Sărurile de aminoacizi sunt ușor solubile în apă. Soluția apoasă de aminoacizi are o reacție neutră, care este, de asemenea, caracteristică sărurilor. Aminoacizii sunt așa-numitele săruri interne (ioni bipolare):
Un astfel de ion se comportă ca un cation într-un mediu acid, deoarece disocierea unei grupări carboxil este suprimată și într-un mediu alcalin aminoacidul se comportă ca un anion:
Valoarea pH la care se atinge concentrația maximă a ionului bipolar se numește punctul izoelectric.
Ca și alți compuși cu funcții mixte, aminoacizii prezintă proprietățile de acizi și amine.
Aminoacizii formează săruri cu baze. Sărurile a-aminoacizilor cu metale grele pot avea un caracter complex:
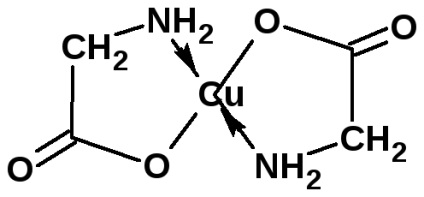
sarea are o culoare intensă albastră.
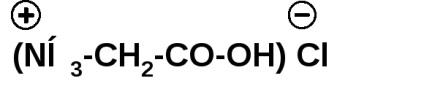
Aminoacizii formează săruri cu acizi anorganici:
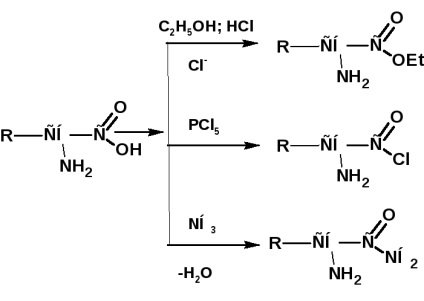
Ca și alți acizi, aminoacizii formează esteri, cloruri acide, amide etc .:
Sub acțiunea acidului azotic, aminoacizii formează acizi hidroxi:
Gruparea amino în aminoacizi este ușor acilată prin acțiunea anhidridelor și a clorurilor acide:
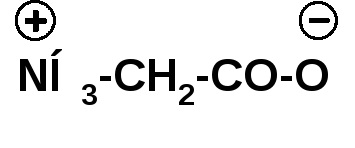
Când se alchilează gruparea amino, se obțin aminoacizii secundari și terțiari. În exces de alchil halogen, se formează baze de amoniu substituite în patru grupuri. Sărurile interne ale unor astfel de baze sunt numite betaine:
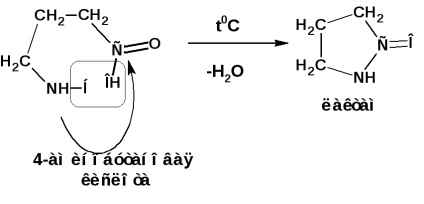
Comportamentul α, β și γ-aminoacizilor după încălzire:
α-aminoacizii formează intermolecular amide ciclice - dicetopiperazine:
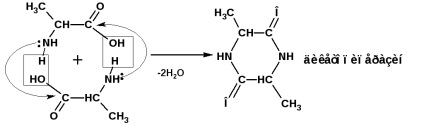
β-aminoacizii, atunci când este încălzit, molecula de amoniac este scindată pentru a forma acizi a, p-nesaturați (sare de amoniu):
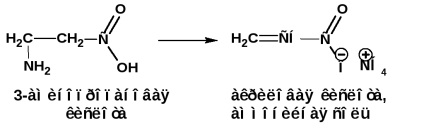
y și ß-aminoacizii, atunci când sunt încălzite, se separă apa și se formează lactame ciclice intramoleculare:
Definiția. Proteinele sunt compuși organici cu greutate moleculară mare. Acestea sunt construite din reziduurile de aminoacizi legate prin legături amidice.
Proteinele sunt împărțite în proteine (proteine simple), care includ numai reziduuri de aminoacizi și proteine (proteine complexe). Aceste proteine sunt construite nu numai din aminoacizi, dar și din alte substanțe: zaharide sau reziduuri de acid fosforic și acizi nucleici.
Proteinele sunt clasificate în trei grupe.
1. Prin solubilitate în apă:
Albumine - solubile în apă și soluții diluate de săruri.
Globuline - puțin solubile în apă și solubile în soluții diluate de săruri.
Prolaminii sunt insolubili în apă și solubili în alcool apos.
Glutelinele - insolubile în apă, în soluții diluate de săruri și alcool apos sunt solubile în soluții de acizi și alcalii.
Scleroproteinele sunt insolubile în apă, soluții diluate de săruri, alcool apos și soluții de acizi și alcalii.
2. Protezele sunt clasificate prin produse de hidroliză:
Nucleoproteinele - hidrolizate la proteine și acizi nucleici.
Fosforoproteinele - hidrolizate în proteine și acid fosforic.
Glucoproteinele - hidrolizate la proteine și carbohidrați.
Cromoproteinele - hidrolizate la proteine și coloranți.
3. Toate proteinele sunt clasificate în funcție de funcțiile din organism:
Proteine care controlează metabolismul.
Ca aminoacizi, proteinele au un caracter amfoteric și un punct izoelectric. Poziția punctului izoelectric pentru proteine poate varia foarte mult de la acid la puternic alcalin.
Toate proteinele sunt optic active. Majoritatea au o rotație stângă.
Există o serie de reacții calitative de culoare pentru proteine:
1. Xantoproteina cu acid azotic. Proteinele tratate cu acid azotic dau o culoare galbenă.
2. Biuret cu săruri de cupru în prezența alcalinei. Proteinele dau o culoare violet datorită formării unei sări complexe.
3. Reacția lui Millon. Cu o soluție de azotat de mercur în acidul azotic, proteinele dau o culoare roșie.
4. Sulfhydryl. Când proteinele sunt încălzite cu o soluție de plumbit de sodiu, se eliberează un precipitat negru de sulfură de plumb.
Proteinele sunt construite din reziduurile de 26 de aminoacizi. Aminoacizii sunt împărțiți în interschimbabile, care pot fi sintetizate de corp și de neînlocuit, pe care corpul uman nu le sintetizează. De exemplu, izoleucina și treonina.
Reziduurile de aminoacizi sunt legate în molecula de proteină prin legături amidice. Legătura amidică în proteine se numește o legătură peptidică:
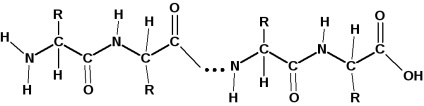
Gruparea carboxil a unei molecule de aminoacid formează o amidă prin interacțiunea cu gruparea amino a moleculei adiacentă de aminoacid. Unități individuale de peptide:
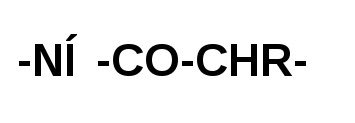
diferă unul de altul numai de radicalii "R" la atomul de carbon α.
Compușii care conțin mai multe resturi de aminoacizi sunt numiți peptide. Compușii cu un număr mare de unități peptidice sunt numiți polipeptide.
In studiul de polipeptide găsesc în principal în care aminoacizii din macromolecula este construit, și care acidul amino este capătul N-terminal (grupare amino liberă), și care este un C-terminus (grupul korboksilnaya liber).
Proteinele sunt complet hidrolizate în aminoacizi prin acid clorhidric concentrat sau acid clorhidric 2% sub încălzire și la presiune ridicată. Hidroliza proteinelor poate fi efectuată sub acțiunea alcalinei. Alegerea reactivului depinde de ce aminoacizi specifici trebuie să fie obținuți din molecula de proteină.
Determinarea aminoacidului N-terminal
Se efectuează utilizând 2,4-dinitrofluorbenzen:
Atunci când 2,4-dinitrofluorbenzenul reacționează cu peptida, fluorul este înlocuit nucleofilic de către gruparea amino terminală. Peptida este apoi hidrolizată. Produsul de reacție al aminoacidului terminal cu 2,4-dinitrofluorbenzen este izolat și acidul este identificat. În cazurile în care 2,4-dinitrofluorobenzenul nu este aplicabil, se utilizează izotiocianatul de fenil.
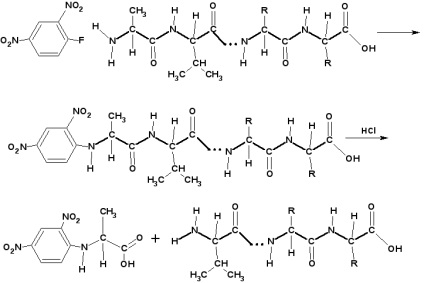
Determinarea aminoacidului C-terminal:
Pentru a determina aminoacidul C-terminal (cu hidroxil liber), peptida este încălzită cu hidrazină la 100 ° C timp de mai multe ore. În acest caz, toți aminoacizii, cu excepția celui terminal, formează hidrazide:
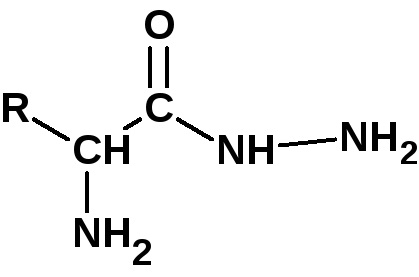
Un aminoacid care nu formează hidrazidă este izolat și identificat.
O metodă mai simplă este utilizarea unei enzime carboxipeptidază care scindează legătura peptidică numai a aminoacidului C-terminal. Poate fi identificat și identificat.
Construcția unui lanț polipeptidic se realizează prin metoda lui E. Fischer. Metoda se bazează pe utilizarea clorurilor acide ale acizilor substituiți cu halogen. De exemplu, trebuie să obțineți lanțul:
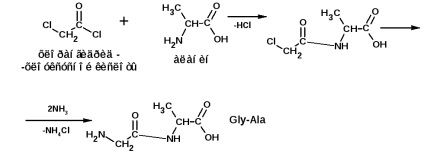
și alantelicinvalină (Ala-Gly-Val):
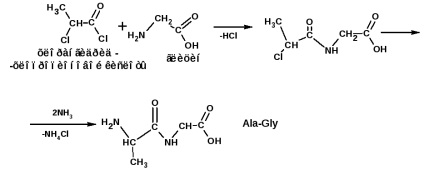
Secvența de aminoacizi legați covalent unul de celălalt în polipeptidă este așa-numita structură primară a proteinei. Dar polipeptida însăși nu este încă o proteină. Peptidele sunt incapabile să funcționeze. Efectuați orice funcții în corpul capabil de sisteme mai complexe, construite din mai multe lanțuri de polipeptide, într-un anumit mod conectat unul cu celălalt. Structurile supramoleculare formate din lanțurile polipeptidice sunt caracterizate printr-o structură secundară, terțiară și cuaternară a proteinei.
Structura secundară se datorează legăturilor de hidrogen dintre gruparea carbonil legată de oxigen legată de peptidă și hidrogenul grupării aminice. Dacă grupările carbonil și amină aparțin lanțurilor polipeptidice diferite, atunci această structură secundară se numește structură β. Dacă gruparea carbonil și amină aparțin aceluiași lanț polipeptidic, atunci o astfel de structură secundară este numită o structură α. Consecința structurii α este existența unui lanț polipeptidic sub forma unei plăci de helix pe cilindru. Lungimea unui reziduu este de 1,5 A 0. Lungimea pasului spiralic este de 5,4 A. Legăturile de hidrogen ale a-helix sunt formate între fiecare prim și al patrulea aminoacid.
Structura terțiară a proteinei este formată ca urmare a plierei sau pliere a mai multor a-helici. În această spirală sunt deținute aproape unul de altul, datorită legăturilor de hidrogen formate de către grupările amino laterale, hidroxi și carboxil, precum și legături disulfidice și electrostatic.
Structura cuaternară este formată ca un agregat al mai multor lanțuri polipeptidice având o structură secundară și terțiară. Lanturile de polipeptide sunt reținute în structura cuaternară prin aceleași forțe ca și în structura terțiară.
Distrugerea structurii primare secundare, terțiare și cuaternare a proteinei se numește denaturare. Denaturarea poate fi cauzată de termică (căldură), chimice, mecanice și t. D. Acest Denaturarea este reversibil și ireversibil. Ireversibil este denaturarea asociată cu distrugerea structurii primare și secundare. După distrugerea lor, proteina nu se recuperează spontan. De exemplu, hidroliza proteinelor sau a ouălor de gătit sau a cărnii, biciuind ouăle albe. Denaturarea structurii terțiare și cuaternare este reversibilă. După distrugerea lor, proteinele se pot recupera spontan odată cu revenirea funcțiilor biologice. De exemplu, înfășurarea buclelor de păr (denaturare termică) sau permeabilitatea chimică.
Articole similare
-
Premix concentrat de ryabushka cu aminoacizi pentru găini și alte păsări de curte 300g
-
Tema de aminoacizi, structura, izomerismul, nomenclatura, producția
-
Afine, retinol, pectină, antociani, antioxidanți, flavonoide, arbutin, aminoacizi
Trimiteți-le prietenilor: