Propanul este o substanță complexă de natură organică. Reprezentant al domeniului omolog al clasei de alcani (hidrocarburi saturate / saturate).
Structura moleculei este prezentată în Fig. 1. În condiții normale, propanul este un gaz fără culoare și miros, ușor solubil în apă. Formează amestecuri explozive cu aerul.
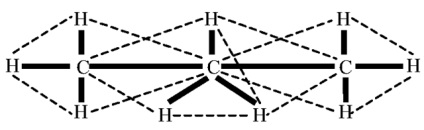
Fig. 1. Structura moleculei de propan.
Formula brută de propan este C3H8. După cum se știe, masa moleculară a unei molecule este egală cu suma masei atomice relative a atomilor care alcătuiesc molecula (valorile masei atomice relative luate din tabelul periodic al lui DI Mendeleev sunt rotunjite la întregi).
Mr (C3H8) = 3 × 12 + 8 × 1 = 36 + 8 = 44.
Masa moleculară (M) este masa de 1 mol de substanță. Este ușor să se arate că valorile numerice ale masei moleculare M și ale masei moleculare relative sunt egale, dar prima cantitate are dimensiunea [M] = r / mol, iar a doua dimensiune este fără dimensiuni:
Aceasta înseamnă că masa molară a propanului este de 44 g / mol.
Exemple de rezolvare a problemelor
Se compune formula pentru conectarea sulfului cu oxigen, dacă fracțiile de masă ale elementelor din el: ω (S) = 40%, ω (O) = 60%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să desemnem numărul de moli ai elementelor care compun compusul pentru "x" (sulf) și "y" (oxigen). Apoi, raportul molar va arăta astfel (valorile masei atomice relative luate din tabelul periodic al DI Mendeleev sunt rotunjite la întregi):
x: y = ω (S) / Ar (S). ω (O) / Ar (O);
x: y = 1,25. 3,75 = 1,3.
Prin urmare, formula pentru conectarea sulfului cu oxigen va avea forma SO3. Acesta este oxidul de sulf (VI).
Calculați cantitatea de oxid de magneziu produsă prin arderea magneziului în 6,4 g de oxigen?
Să notăm ecuația reacției de interacțiune dintre magneziu și oxigen:
Calculați cantitatea de oxigen prin formula:
Pentru aceasta este necesar să se indice masa molară de oxigen (valoarea maselor atomice relative, luate din tabelul periodic al lui DI Mendeleyev, rotunjite la cel mai apropiat număr întreg). După cum se știe, masa molară a unei molecule este egală cu suma masei atomice relative a atomilor care alcătuiesc molecula (M = Mr):
M (O2) = 2 x Ar (O) = 2 x 16 = 32 g / mol.
Apoi, cantitatea de oxigen va fi:
n (02) = 6,4 / 32 = 0,2 mol.
Conform ecuației de reacție n (O2): n (MgO) = 1.2, înseamnă:
n (MgO) = 2 x n (O2) = 2 x 0,2 = 0,4 mol.
Să găsim masa molară de oxid de magneziu (ipoteza indicată în calculul masei moleculare de oxigen este valabilă în acest caz):
M (MgO) = Ar (Mg) + Ar (O) = 24 + 16 = 40 g / mol.
Determinați masa de oxid de magneziu:
m (MgO) = n (MgO) xM (MgO);
m (MgO) = 0,4 x 40 = 16 g.
Articole similare
Trimiteți-le prietenilor: