Se numește polarizare schimbare potențiale ale electrozilor în timpul fluxului de curent electric, precum și procesele care conduc la o reducere a ratei de coroziune ca urmare a modificărilor potențiale, și, prin urmare, reducerea curentului de coroziune. Când circuitul dintre catod și anod este deschis (până în momentul τ1 Figura 1.), catod și anod au potențialul de φk Valori 0 și 0, respectiv φa - un potențiale staționare sau de echilibru. După circuitul (după τ1) între anod și catod un curent electric începe să curgă și catod și anod potențiale sunt schimbate la valorile φk itφa. astfel diferența de potențial se schimbă de la E0 la EM Offset potențialele anod și catod și cuprind ΔEa ΔEk - anodice și catodice de polarizare. Ca rezultat, viteza de coroziune scade polarizare, potențialul anodului devine un potențial mai puțin negativ și mai puțin pozitiv catod, diferența de potențial scade și coroziune curent scade.
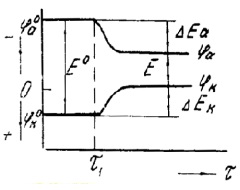
Figura 1 - Diagrama modificării potențialului catodului și anodului după închiderea circuitului
Cauza polarizare este frânare (viteză mică) a uneia sau a mai multor componente ale unui proces de coroziune electrochimica. Ca urmare, rata de acumulare a sarcinilor negative anod sau pozitiv la catod devine mai mică decât rata de transfer de electroni de la anod la catod și anod și catod Potențialele sunt modificate. Deoarece viteza întregului proces este determinată de cea mai mică viteză (de limitare a vitezei) pas, viteza de coroziune rezultată polarizare încetinește în ansamblu. Polarizare anodică (decelerare a procesului anodic) pot fi cauzate de o recuperare lentă a ionilor metalici în soluție (limitează reacția chimică), formarea pe suprafața metalică a unui film de oxid protector sau retragerea lentă a ionilor metalici de la suprafață, ceea ce face dificilă pentru a produce (difuzie de limitare) care urmează. polarizarea catodică (inhibarea procesului catodic) poate fi cauzată de un ritm lent de oxidare a cationilor sau moleculele de pe suprafața soluției de metal (limitează reacția chimică), sau furnizarea lenta a ionilor de pisică sau molecule hoațe la tracțiune la recuperarea produkgov suprafața catodului și ieșirea de la catod în soluție (limite de difuzie).
Depolarizarea este fenomenul care contribuie la creșterea ratei proceselor de coroziune și, prin urmare, la o scădere a polarizării electrozilor. Veschegva, reducerea polarizării se numește depolarizatoare. Cele mai comune depolarizatoare catodice sunt hidrogenul și oxigenul, principalii oxidanți din soluții. Coroziunea care implică ioni de hidrogen este posibilă în cazul în care potențialul de echilibru al metalului este negativ decât potențialul de echilibru al electrodului hidrogen în condițiile date. Efectul depolarizant va avea o creștere a conținutului de soluție de hidrogen. Coroziunea care implică molecule de oxigen este cel mai frecvent caz. Efectul depolarizant va crește conținutul în soluția de oxigen. De asemenea, acțiunea depolarizantă va exercita o dizolvare a filmului de oxid de protecție și toți factorii care facilitează accesul oxidanților la suprafața metalului, de exemplu, amestecarea.
Pe site-ul nostru puteți ordona decizia de sarcini pe toate secțiunile de știință a materialelor.
Articole similare
Trimiteți-le prietenilor: