Modelul structurii atomului
Cercetare științifică, desfășurată la sfârșitul secolului XIX - începutul secolului XX. ne-a permis să propunem următorul model al structurii atomului:
- În centrul atomului este un nucleu încărcat pozitiv care ocupă o parte nesemnificativă din spațiul din interiorul atomului.
- Întreaga sarcină pozitivă și aproape întreaga masă a atomului sunt concentrate în centrul său.
- Nucleul atomilor constă din protoni și neutroni (nucleoni). Numărul de protoni din nucleu este egal cu numărul ordinal al elementului, iar suma numărului de protoni și neutroni corespunde numărului său de masă.
- Electronii se rotesc in jurul nucleului de-a lungul orbitelor inchise. Numărul lor este egal cu încărcătura nucleară pozitivă.
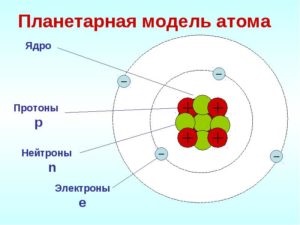
Nucleul este partea centrală pozitiv încărcată a atomului în care masa sa este concentrată.
Electronul este o particulă cu o sarcină negativă, care este adoptată condiționat ca -1.
Neutronul este o particulă neutră care nu are o încărcătură electrică. Masa neutronică este 1 a. e. m.
Protonul este o particulă încărcată pozitiv, cu aceeași masă ca și neutronul. Încărcarea protonului este egală cu sarcina electronului și este opusă semnului.
Numărul de protoni din nucleul unui atom este egal cu numărul de electroni. Acest număr determină încărcarea nucleului atomic al elementului și numărul său ordinal în tabelul periodic.
În anumite condiții, neutronul poate fi transformat într-un proton și invers.
Masa atomică a elementelor din tabelul periodic reprezintă media numărului de masă al amestecurilor naturale de izotopi. Prin urmare, ei nu pot, după cum credea Mendeleev, să servească drept principala caracteristică a atomului și a elementului. Această caracteristică este sarcina nucleului atomului. Acesta determină numărul de electroni din atomul neutru, care sunt distribuiți în jurul nucleului în anumite orbite și determină proprietățile chimice ale atomilor. Ca rezultat, a fost dată o nouă definiție a elementului chimic și a fost perfecționată formularea legii periodice:
Un element chimic este o colecție de atomi cu aceeași încărcătură nucleară.
Proprietățile elementelor, precum și proprietățile și formele compușilor lor, se află într-o dependență periodică de încărcarea nucleului atomic al elementului.
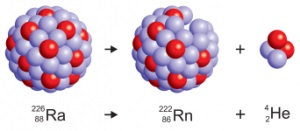
Fenomenul de radioactivitate descoperit de Becquerel a fost primul exemplu de reacții nucleare - transformările nucleelor unui element în nucleele unui alt element. Acum sunt cunoscute numeroase reacții nucleare; toate se referă la fenomene fizice și, prin urmare, nu sunt luate în considerare în cursul obișnuit al chimiei.
Prevederi de bază ale legii periodice a DI Mendeleyev
Baza de clasificare a elementelor chimice ale lui Mendeleev a luat o mulțime de atomi de elemente. Cu bine-cunoscut în momentul în care elementele în ordine crescătoare a greutăților atomice, Mendeleev a constatat că proprietățile elementelor reapar periodic. In 1869 Mendeleev a descoperit legea periodic în 1871, astfel că a formulat: „Proprietățile fizice și chimice ale elementelor care apar în proprietățile corpurilor simple și complexe formate de acestea, sunt în dependență periodică de greutatea atomică.“
În prezent, caracteristica principală care determină apartenența unui atom la un element este încărcarea nucleului atomului, care corespunde numărului de serie al elementului din sistemul periodic. Prin urmare, formularea modernă a legii periodice este după cum urmează: proprietățile substanțelor simple, precum și formele și proprietățile compușilor de elemente chimice, se află într-o dependență periodică de încărcarea nucleelor atomilor elementelor sau de numărul atomic al elementelor.
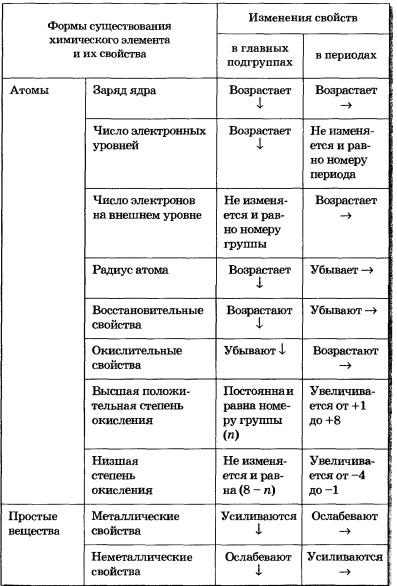
De exemplu, în seriile de la litiu la neon, deoarece încărcăturile de nuclei cresc, proprietățile elementelor se schimbă într-o direcție foarte precisă. Valența de oxigen de la litiu la azot în fiecare element succesiv este mărită cu una, iar valența de hidrogen de la carbon la fluor, dimpotrivă, scade cu una. Proprietățile metalice de la litiu la fluor slăbesc treptat, iar proprietățile nemetalice sunt întărite.
În seria de la sodiu la argon, proprietățile elementelor repetă în mare măsură proprietățile elementelor de la litiu la neon. Și repetarea se manifestă într-o anumită ordine: sodiul repetă proprietățile de litiu, magneziu - beriliu, aluminiu - bor și așa mai departe. După argon, potasiul repetă proprietățile de sodiu și litiu, calciu - magneziu și beriliu, cu alte cuvinte, se repetă proprietățile elementelor sistemului periodic. Această periodicitate nu poate fi considerată o simplă repetare a proprietăților. Cu toate acestea, proprietățile elementelor se repetă în grade diferite.
Întregul set de elemente poate fi reprezentat sub forma unui singur sistem natural - un sistem periodic de elemente chimice.
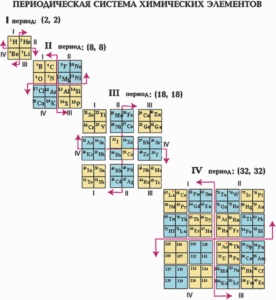
În tabelul periodic, toate elementele sunt de 7 perioade. Prima perioadă include 2 elemente - hidrogen și heliu. De la potasiu la krypton și de la rubidium la xenon, a patra și a cincea perioadă includ deja 18 elemente. A șasea perioadă conține 32 de elemente. A șaptea perioadă nu sa terminat. Periodicitatea în repetarea proprietăților elementelor chimice este diferită. Primele trei perioade sunt numite mici, celelalte sunt mari.
Dacă, în perioade mici, când numărul ordinal crește, toate proprietățile chimice ale elementelor se schimbă secvențial, apoi în perioade mari, anumite proprietăți ale elementelor se repetă în această perioadă.
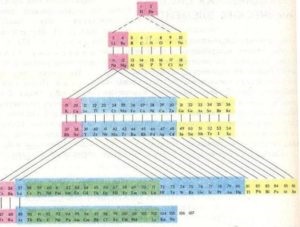
Sistemul periodic al elementelor chimice poate fi afișat sub forma unui tabel. Au fost create multe variante de tabele diferite. Cu toate acestea, cele mai evidente și, prin urmare, cele mai frecvent utilizate sunt formele extinse și scurtate ale tabelului.


formă extinsă a tabelului se obține atunci când perioadele de elemente succesive de a plasa sub formă de rânduri orizontale, astfel încât elemente similare în proprietățile lor dovedit strict una deasupra celeilalte. In acest tabel sunt separate prin perioade scurte de timp - pe elementul 2 la începutul și la sfârșitul tabelului 6, iar între a patra și a cincea perioade ale elementelor 10, în a șasea - 32 elemente (14 lantanide împreună cu lantan plasate în aceeași cușcă); doar 10 coloane. Elemente cu proprietăți similare în coloanele verticale ale acestei tabele formează subgrupuri. Subgrupurile cu elemente de a doua și a treia perioade scurte numite principale, și altele - laterale. Totalul Tabelul 8 principal și 8 subgrupe secundare: total 16. Principalele subgrupelor desemnate de sufixul „a“ - Ia, IIa. Subgrupurile sunt desemnate de indicele "b" - Ib, IIb, etc.
În subgrupul IIIb, există 14 elemente din familia de lantanide și actinide, redate ca rânduri separate în afara mesei principale. Acest lucru se datorează faptului că elementele acestor familii au o mare asemănare cu proprietățile chimice și sunt plasate într-o singură celulă a mesei principale.
În forma abreviată a tabelului din tabelul periodic, subgrupurile principale și secundare sunt combinate într-un singur grup, dar sunt deplasate orizontal astfel încât elementele principalelor și sub-subgrupurilor formează coloane separate. Perioadele mari în forma abreviată a tabelului formează două serii. Cea mai frecvent folosită este forma abreviată a tabelului, datorită compactării și ușurinței sale.
Există, de asemenea, multe alte forme ale sistemului periodic:
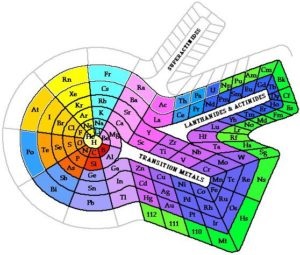
Structura atomului și legea periodică
Studiul structurii atomilor și al proprietăților chimice ale elementelor corespondente cu caracterul distribuției electronilor asupra nivelelor de energie în atomi a arătat că proprietățile chimice ale elementelor sunt determinate în principal de structura carcasei de electroni exterioare.
Întrucât periodicitatea schimbării proprietăților chimice ale elementelor nu este aceeași, adică sistemul periodic include o perioadă de 2 elemente, două pentru 8, două pentru 18 și un 32 elemente. Ultima, a șaptea, perioadă este incompletă și conține 19 elemente. O astfel de periodicitate este legată de regularitățile de umplere a nivelurilor de energie ale unui atom cu electroni (principiul lui Pauli, regula Gund, regula Klechkovski):
Două reguli decurg din seria de mai sus: la nivelul energiei externe a oricărui atom nu poate exista mai mult de 8 electroni, iar la nivelul energiei preexistente a oricărui atom nu poate exista mai mult de 18 electroni. Deoarece orice nivel extern nu poate conține mai mult de 8 electroni, învelișurile exterioare cu 8 electroni sunt numite complete. Sunt caracteristice numai atomilor de gaz nobili și sunt foarte stabili.
În funcție de orbitale, care sunt umplute cu electroni în formarea cochililor electronici, se disting s-, p-, d- și f- elementele.
Cunoscând secvența de umplere a orbitalilor atomici cu electroni, se pot înțelege caracteristicile sistemului periodic de elemente chimice. Deoarece fiecare perioadă începe cu formarea unei noi cochilii de electroni, numărul de cochilii de electroni de la atom este egal cu numărul perioadei în care este localizat atomul. Elementele s- și p constituie principalele subgrupe ale tabelului periodic, d- și f-elementele fiind subproduse.
Natura schimbării proprietăților elementelor în perioade și grupuri
În elementele principalelor subgrupe (acestea sunt elementele s și p), numărul de electroni de pe cochilia exterioară este egal cu numărul grupului.
Toate elementele d de pe carcasa electronică exterioară conțin doar doi electroni, deoarece umple d-orbitalul stratului pre-existent. Prin urmare ele sunt numite d-elemente. Natura schimbării proprietăților în perioada pentru aceste elemente va fi determinată în primul rând de o schimbare a stării învelișului de electroni pre-extern. Prin urmare, pentru d-elementele din perioada respectivă, proprietățile nu se schimbă atât de intens ca în elementele s sau p, toate
Elementele d sunt metale.
Elementele f sunt umplute în principal cu orbite f, care sunt acoperite de cochilii exterioare pre-externe și cu două electroni cu opt electroni. Prin urmare, efectul configurației electronice a f-shell-ului asupra proprietăților nu este practic reflectat, iar elementele f sunt atât de similare încât sunt plasate într-o singură celulă a mesei.
Împărtășește în social. crearea de rețele
Articole similare
Trimiteți-le prietenilor: