Bazele biochimiei. Chimie fizică
Apa ca solvent
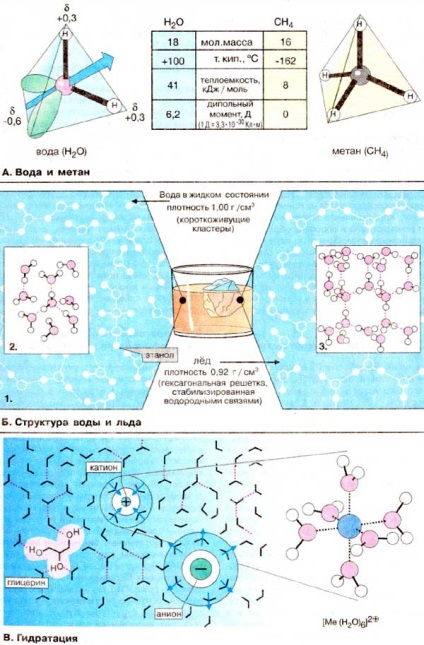
Proprietățile unice ale H2O de apă devin vizibile în comparație cu metanul (CH4). Ambele molecule sunt identice în masă și mărime. Cu toate acestea, punctul de fierbere al apei este cu 250 ° C mai mare decât punctul de fierbere al metanului. Ca rezultat, apa de pe suprafața Pământului este în stare lichidă, iar metanul este în stare gazoasă. Punctul de fierbere ridicat este o consecință a căldurii specifice ridicate de evaporare, care la rândul său este cauzată de distribuția neuniformă a densității de electroni în molecula de apă. Moleculă de apă are forma unui tetraedru, în centrul căruia este localizat un atom de oxigen. Două vârfuri ale tetraedrului sunt ocupate de perechi de electroni liberi de un atom de oxigen (verde), iar celelalte două - atomii de hidrogen. Prin urmare, legăturile H-O-H sunt aranjate unghi unul față de celălalt. În plus, datorită electronegativității ridicate a atomului de oxigen, legătura O-H este polară (vezi pagina 14). Hidrogeni transporta o sarcină parțială pozitivă de aproximativ 0,4, și un atom de oxigen - sarcină negativă parțială de aproximativ 0,6, adică o moleculă de apă este un dipol electric .. De aceea, fiecare moleculă de apă, ca un magnet mic atrage datorită formării de punți de hidrogen (B) patru molecule (vezi. P. 14). Când se evaporă apa, distrugerea acestor numeroase legături de hidrogen necesită o cheltuială mare de energie. Moleculele de metan sunt nepolar, nu sunt dipoli și interacționează relativ slab unul cu celălalt. Ca rezultat, metanul lichid se evaporă la temperaturi foarte scăzute.
B. Structura apei și a gheții
Structura bipolară a moleculelor de apă favorizează formarea legăturilor de hidrogen (vezi pagina 14). Fiecare moleculă prezintă proprietăți ale donatorului și ale acceptorului de hidrogen. Prin urmare, în apă în stare lichidă, multe molecule sunt legate între ele de "punți" de hidrogen (legături) (1). iar asociații care rezultă sunt în echilibru dinamic. Deseori structuri tetraedice formate, așa-numitele "grupuri" de apă (2). Pe măsură ce temperatura este scăzută, fracțiunea de clustere crește până la debutul cristalizării. La presiunea atmosferică normală, apa cristalizează la 0 ° C, în timp ce majoritatea moleculelor de apă sunt încorporate în rețeaua hexagonală (3). Deoarece în stare solidă distanța dintre molecule este în medie mai mare decât în lichid, densitatea gheții este mai mică decât densitatea apei. Această proprietate a apei este foarte importantă într-un sens ecologic, chiar dacă pentru că în timpul iernii se formează un strat de gheață pe suprafața rezervoarelor și rar îngheață până la fund.
Spre deosebire de majoritatea altor lichide, apa este un solvent ideal pentru disocierea substanțelor. În câmpul electric al unui ion, moleculele de apă formează structuri regulate în funcție de sarcina ionului. Această coajă hidratată protejează ionul de ionii încărcăturii opuse. Apa are o constantă înaltă a permitivității (78), adică în apă, atracția electrostatică a doi ioni încărcați opuși este redusă de aproximativ 80 de ori (1/78). Moleculele de apă situate în sfera interioară direct în apropierea ionului sunt practic imobilizate (legate de acest ion) și se mișcă împreună cu ionul central. Este ușor solubil în apă și compuși neutri cu mai multe grupări hidroxil, cum ar fi glicerol (în diagrama din stânga) sau zaharuri, deoarece acestea sunt capabile să formeze legături de hidrogen cu molecule de solvent.
Articole similare
Trimiteți-le prietenilor: