Metale alcaline. Oxizi, peroxizi, hidroxizi și săruri ale metalelor alcaline
12.1. Caracteristicile generale ale metalelor alcaline
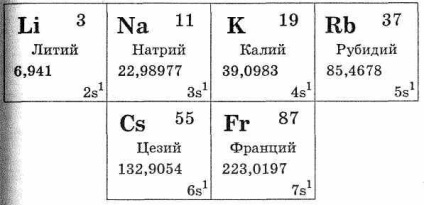
Grupa metalelor alcaline cuprinde următorul set de elemente: litiu Li, Na sodiu, potasiu, K, rubidiu, Rb, Cs cesiu, franciu pr Ele sunt în subgrupul principal al grupului I al sistemului periodic. Toate aceste metale sunt similare în sensul că există un electron pe stratul lor de electroni extern (vezi Tabelul 28). Metalele alcaline se numără printre elementele s. Electronul stratului electronic extern al atomului de metal alcalin, în comparație cu alte elemente ale aceleiași perioade, este îndepărtat din nucleu, adică raza atomului de metal alcalin, în comparație cu cea mai mare raza atomilor elementelor în aceeași perioadă. În acest sens, electronul de valență al stratului exterior al atomilor de metal alcalin este detașat cu ușurință, transformându-i în ioni încărcați singular. Acest lucru se datorează faptului că compușii metalelor alcaline cu alte elemente sunt construiți în funcție de tipul de legătură ionică.
În reacțiile de oxidare-reducere, metalele alcaline se comportă ca agenți reducători puternici și această capacitate crește de la metal la metal cu o creștere a încărcăturii nucleului atomic.
Proprietățile fizice și chimice ale elementelor din subgrupul principal din grupa I
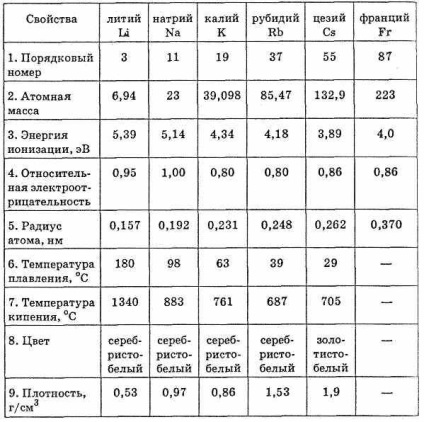
Printre metale, metalele alcaline prezintă cea mai mare activitate chimică. În seria de solicitări, toate metalele alcaline sunt situate la începutul rândului. Electronul nivelului de electron extern este singurul electron de valență, astfel că metalele alcaline din orice compuși sunt unic-valent. Gradul de oxidare a metalelor alcaline este de obicei 1.
Metalele alcaline sunt ușor oxidate în aer, în apă și în acizi. Pentru a preveni oxidarea, ele sunt depozitate în vase închise (cu vid) sau sub un strat de eter, kerosen și altele asemenea. Oxidarea metalelor alcaline într-o atmosferă de oxigen are loc foarte viguros, cu formarea unui peroxid de metal de tipul R2O2. Oxizii pot fi obținuți numai în condiții speciale.
Oxizii de metale alcaline R2O au proprietăți de bază pronunțate, reacționează activ cu apă, acizi și oxizi de acizi.
Atunci când metalele alcaline sau oxizii lor reacționează cu apă, se formează hidroxizi de metale alcaline - ROH alcalini - sunt baze puternice, ale căror proprietăți de bază cresc cu numărul atomic al elementului. Proprietățile reducătoare ale metalelor alcaline sunt atât de pronunțate încât atunci când sunt încălzite într-o atmosferă de hidrogen se formează hidruri în care gradul de oxidare a hidrogenului este -1. Compușii hidrogen ai metalelor alcaline corespund formulei RH. Sunt substanțe cristaline albe.
^ 12,2. Prepararea și proprietățile chimice ale metalelor alcaline pe baza de sodiu și potasiu
Fiind în natură
Prepararea de sodiu și potasiu
Sodiul este obținut prin electroliza clorurii sau hidroxidului de sodiu. În timpul electrolizei topiturii de NaCl, sodiul este eliberat pe catod:
Na e - Na ° a la anod - clor: 2Cl - 2e - Cl 0 2
În timpul electrolizei topiturii NaOH, sodiul este eliberat pe catod și apa și oxigenul sunt eliberați la anod:
Datorită costului ridicat al hidroxidului de sodiu, principala metodă modernă de obținere a sodiului este electroliza topiturii de NaCl.
Potasiul poate fi de asemenea obținut prin electroliza KC1 și KOH topite. Cu toate acestea, această metodă de obținere a potasiului nu a găsit distribuție din cauza unor dificultăți tehnice (randament scăzut al curentului, dificultate în furnizarea echipamentelor de siguranță). Producția industrială modernă de potasiu se bazează pe următoarele reacții: KCl Na = NaCl K (1)
În procedeul (1), vaporii de sodiu sunt trecuți prin clorură de potasiu topită la 800 ° C, iar vaporii de potasiu care rezultă se condensează. În procedeul (2), reacția dintre hidroxidul de potasiu topit și sodiul lichid este contracurent la 440 ° C într-o coloană de reacție de nichel.
Sodiul și potasiul sunt metale de culoare alb-argintiu, foarte moi, ușor de tăiat cu un cuțit.
Sodiul natural constă dintr-un izotop 23 11 Na, potasiu din două izotopi stabili 39 19 K (93,26%) și 41 19 K (6,73%) și un radioactiv 40 19 K (0,01%). Studiile utilizează izotopi radioactivi obținuți prin mijloace artificiale: 22 11 Na,
Atomii de sodiu și potasiu, în timpul interacțiunii chimice, emit electroni de valență ușor, trecând în ioni încărcați pozitiv: Na și K. Ambele metale sunt agenți reducători puternici.
Dacă sodiul și potasiul sunt oxidate într-o cantitate mică de oxigen la o temperatură de aproximativ 180 ° C, se obțin oxizi:
În legătură cu oxidarea ușoară și rapidă a sodiului și a potasiului, ele sunt depozitate sub un strat de kerosen sau parafină, cu parafină mai respectuoasă, deoarece în kerosen, o anumită cantitate de aer se dizolvă, iar oxidarea, deși lentă, are loc.
Sodiul și potasiul pot da compuși cu hidrogen - o hidrură în care hidrogenul prezintă o stare de oxidare de -1. Este un compus asemănător sarei, care diferă de apa volatilă datorită naturii legăturii chimice și gradului de oxidare.
Compuși nativi ai elementelor principalelor subgrupe din grupurile IV-VII. Hidrurile metalice sunt ușor descompuse de apă pentru a forma alcalii și hidrogenul corespunzător:
Sodiul și potasiul pot reacționa nu numai cu oxigen și hidrogen, ci și cu multe substanțe simple și complexe: 2Na S = Na2S2KCl2 = 2KSl
Sodiu și potasiu reacționează nu numai simplu, ci și complexitate TION cu substanțe, de exemplu apa, deplasând hidrogen din aceasta:
Potasiul reacționează chiar mai violent decât sodiul: 2K 2N 2 O = 2KOH H2 reacții
Este imposibil să stingeți un metal alcalin cu apă. Se toarnă cu ulei mineral sau se acoperă cu un amestec de talc și NaCI. Flacăra incoloră a arzătorului de gaz este colorată cu sodiu în galben și cu potasiu în violet.
Sodiul și aliajele sale cu potasiu sunt utilizate ca purtători de căldură în reactoarele nucleare. Vaporii de sodiu sunt umpluți cu lămpi cu descărcare în gaz. Sodiu - agent în metalurgie reducător (in, producerea Ti, Zr, Ta), este utilizat drept catalizator în sinteza organică și alte zone ..
Potasiul este utilizat în ingineria electrică, este principalul | componenta nutritivă a plantelor.
^ 12,3. Oxizi, peroxizi, hidroxizi și săruri ale metalelor alcaline pe baza de sodiu și potasiu
Oxizi de sodiu și potasiu nu contează prea mult. Acestea reacționează puternic cu apă, formând o sifonă caustică și potasiu caustic, respectiv:
Acestea prezintă toate proprietățile oxizilor de bază.
Peroxidul de sodiu Na2O2 este o pulbere gălbui. Acesta poate fi considerat un fel de sare de peroxid de hidrogen, deoarece structura sa este aceeași cu cea a H2O2. Ca și peroxidul de hidrogen,
Hidroxidul de sodiu este cel mai puternic oxidant. Când se dizolvă în apă, formează alcalii, peroxid de hidrogen și oxigen:
Peroxidul de hidrogen este, de asemenea, format prin acțiunea acizilor diluați pe peroxidul de sodiu:
Cu dioxid de carbon de sodiu, peroxidul de sodiu reacționează conform ecuației:
Prin urmare, este utilizat în aparatul de respirație pentru recuperarea monoxidului de carbon (IV) care absorb aerul și eliberarea oxigenului.
Peroxidul de sodiu, în plus, este utilizat pentru albirea țesuturilor, osului, părului etc.
Compușii foarte importanți sunt hidroxidul de sodiu sau hidroxidul de sodiu NaOH, se numește și sodă caustică sau caustică și hidroxid de potasiu sau KOH de potasiu caustic. Acestea sunt numite și alcalii caustice. ele sunt ușor solubile în apă.
Hidroxidul de potasiu și hidroxidul de sodiu sunt substanțe cristaline opace albe opace. În apă se dizolvă cu o cantitate mare de căldură.
În soluții apoase, ele sunt aproape complet disociate și sunt alcalii puternice:
NaOHyNa OH - Konjk OH -
Afișați toate proprietățile bazelor.
Hidroxizii de sodiu și potasiu solizi și soluțiile lor apoase absorb monoxidul de carbon (IV):
În stare solidă în aer, NaOH și KOH absorb umiditatea, astfel încât acestea sunt utilizate ca dezumidificatoare de gaze.
În industrie, hidroxidul de sodiu și hidroxidul de potasiu se prepară prin electroliza soluțiilor concentrate de NaCl și KC1. În același timp, clorul și hidrogenul sunt produse simultan. Catodul este o plasă, anodul este grafit.
Potasiul într-un număr de potențiale electrodice standard este localizat până la aluminiu, iar ionii săi sunt mult mai greu de recuperat decât moleculele de apă. Ioni de H în soluție sunt foarte mici. Prin urmare, numai moleculele de apă sunt descărcate la catod, cu eliberarea hidrogenului molecular. Ionii clorului, într-o soluție concentrată, se oxidează mai ușor (se oxidează) decât moleculele de apă, deci ionii de clor sunt evacuați la anod.
Ecuația generală de electroliză în formă ionică:
În mod similar, se efectuează electroliza soluției de NaCI. Soluția care conține NaOH și NaCI suferă evaporare, rezultând precipitarea clorurii de sodiu (are mult mai puțină solubilitate și variază foarte puțin cu temperatura), care este separată și utilizată pentru o electroliză ulterioară.
Spațiul anodic și catodic este separat de o diafragmă astfel încât produsele rezultate să nu interacționeze între ele, de exemplu:
Cl2 NaOH = NaCIO NaCI H20
Soda caustică este utilizată în multe industrii, de exemplu, pentru rafinarea petrolului, producția de săpun din grăsimi, în industria hârtiei, în producția de fibre și coloranți artificiali, în producția de medicamente, în viața de zi cu zi etc.
Un produs mai scump, hidroxidul de potasiu, este utilizat mai rar decât NaOH.
Sărurile de sodiu și potasiu formează toți acizii. Aproape toate sărurile lor sunt solubile în apă. Cele mai importante dintre ele sunt următoarele.
Clorura de sodiu NaCl este un condiment necesar pentru alimente, se folosește pentru conservarea produselor alimentare și serveste și ca materie primă pentru producerea de hidroxid de sodiu, clor, acid clorhidric, sodă etc.
Aplicarea de sodă - vezi tabelul. 25 pe p.
^ Sulfatul de sodiu Na2SO4 este utilizat în producția de sifon și sticlă. Din soluții apoase,
Na2S04 • 10H2O, numit sarea lui Glauber. Aplicată în medicină ca un laxativ.
Pot fi menționate în special săruri de potasiu, deoarece unele dintre ele sunt utilizate pe scară largă ca îngrășăminte:
1) săruri brute, care sunt săruri naturale măcinate, în principal silyvinită NaCl • KCI și KCI-ka • MgS04 • 3H20;
2) Îngrășămintele concentrate obținute ca urmare a prelucrării sărurilor de potasiu naturale sunt KCI și K2S04;
3) cenușa de lemn și turbă care conține potasiu K2CO3.
Articole similare
Trimiteți-le prietenilor: