Varietăți de legare chimică
Cochiliile exterioare ale tuturor elementelor, cu excepția gazelor nobile, sunt NEINFINITE și în procesul de interacțiune chimică, acestea sunt COMPLETE.
Legătura chimică se formează datorită electronilor cochiliilor de electroni exteriori, dar se realizează în moduri diferite.
Există trei tipuri principale de legături chimice:
- legătura covalentă și soiurile sale: legătura covalentă polară și nepolară;
Legarea chimică ionică este o legătură formată din atragerea electrostatică a cationilor către anioni.
legătură ionică are loc între atomii de carbon, care diferă semnificativ de la fiecare alte valori electronegativitate, deci o pereche de electroni care formează o legătură puternic părtinitoare față de unul dintre atomii, deci poate fi considerat aparținând atomului elementului.
Electronegativitatea este abilitatea atomilor de elemente chimice de a-și atrage propriile electroni și altele.
Natura legăturii ionice, structura și proprietățile compușilor ionici sunt explicate din poziția teoriei electrostatice a legăturilor chimice.
De exemplu: 2Na 0 + Cl2O = 2Na + Cl -
In arderea de sodiu metalic în clorul rezultat -vosstanovitelnoy reacției de oxidare format cationi de sodiu elementul puternic electropozitive și anioni element de clor puternic electronegativ.
Concluzie: legătura chimică ionică se formează între atomii metalici și nemetalici, care sunt foarte diferiți în ceea ce privește electronegativitatea.
O legătură covalentă este legarea atomilor prin intermediul unor perechi electronice comune (împărțite între ele).
Să luăm în considerare apariția unei legături covalente nepolare prin exemplul formării unei molecule de hidrogen de la doi atomi de hidrogen. Acest proces este deja o reacție chimică tipică, datorită unei substanțe (hidrogen atomic), alcătuind un alt hidrogen molecular. Un semn extern al "rentabilității" energetice a acestui proces este alocarea unei cantități mari de căldură.
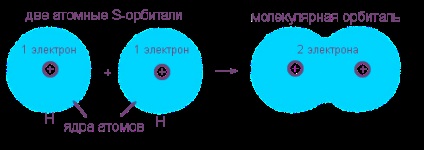
Carcasa electronică a atomilor de hidrogen (unul s-electron fiecare atom) fuzionată la norul de electroni totală (molecular orbital) unde ambele electron „serviciu“ nucleu dacă „ei“ este un miez sau „străin“. Noua coajă de electroni este similară cu carcasa electronică completă a unui gaz inert de heliu de la doi electroni: 1s 2.
În practică, se folosesc metode mai simple. De exemplu, chimistul american J. Lewis, în 1916, a propus să desemneze electroni
lângă simbolurile elementului. Un punct reprezintă un electron. În acest caz, formarea unei molecule de hidrogen din atomi este scrisă după cum urmează:
Luați în considerare legarea a doi atomi de clor 17C1 (sarcina nucleului Z = 17) într-o moleculă diatomică din pozițiile structurii cojilor de electroni ai clorului.
La nivelul electronic extern al clorului se află s 2 + p 5 = 7 electroni. Deoarece electronii din nivelele inferioare nu participă la interacțiunea chimică, punctele denotă numai electronii
al treilea nivel. Acești electroni externi (7 bucăți) pot fi aranjați sub forma a trei perechi de electroni și un electron neparticipat.
După unificarea a doi electroni nepartiți într-o moleculă, se obține o nouă pereche de electroni:
În acest caz, fiecare dintre atomii de clor este înconjurat de
electroni. Acest lucru poate fi ușor verificat prin apropierea oricărui atom de clor.
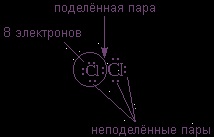
O legătură covalentă este formată numai de o pereche de electroni situați între atomi. Se numește
Următoarele perechi de electroni sunt numite
Ele umple coaja și nu iau parte la legare.
Atomii formează legături chimice ca rezultat al socializării unui astfel de număr de electroni pentru a obține o configurație electronică similară configurației electronice complete a atomilor de elemente nobile.
Conform teoriei lui Lewis și regulii de octeți, legătura dintre atomi poate fi efectuată nu neapărat de una, ci și de
Împărțite perechi, dacă este cerută de regula octeților. Astfel de legături sunt numite
dublu și triplu.
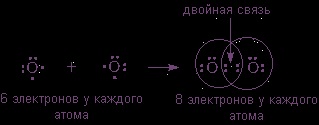
pot forma o moleculă diatomică cu un octet de electroni pentru fiecare atom numai atunci când două perechi împărțite sunt plasate între atomi:
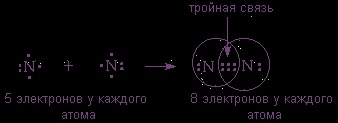
(2s 2 2p 3 pe ultima coajă) sunt, de asemenea, legate de o moleculă diatomică, ci de a organiza octetul de electroni de care au nevoie pentru a le aranja deja trei perechi împărțite:
Concluzie: o legătură covalentă nepolară se produce între atomii cu aceeași electronegativitate, adică între atomii unui element chimic - cel ne-metalic.
De exemplu: în moleculele H2Cl2, N2P4Br2 este o legătură covalentă nepolară.
Legarea covalentă polară
ocupă o poziție intermediară între o legătură pur covalentă și o legătură ionică. La fel ca cel ionic, poate apărea doar între doi atomi de diferite tipuri.
Ca un exemplu, luați în considerare formarea de apă în reacția dintre atomii de hidrogen (Z = 1) și oxigen (Z = 8). Pentru a face acest lucru, este convenabil să notați mai întâi formulele electronice pentru carcasele exterioare ale hidrogenului (1s1) și oxigenului (.2s2 2p4).
Se pare că pentru aceasta este necesar să se ia doar doi atomi de hidrogen la un atom de oxigen. Cu toate acestea, natura este astfel încât proprietățile acceptoare ale atomului de oxigen sunt mai mari decât cele ale atomului de hidrogen (motivele pentru care sunt puțin mai târziu). Prin urmare, perechile de electroni de legare din formula Lewis pentru apă sunt ușor deplasate la nucleul atomului de oxigen. Legătura din molecula de apă este covalentă polară, iar pe atomi apar particule pozitive și negative parțiale.
Concluzie: o legătură polară covalentă apare între atomii cu electronegativitate diferită, adică între atomii de elemente chimice diferite - nemetalici.
- legătura polară covalentă.
În prezent, se obișnuiește să se prezinte perechi de electroni (adică legături chimice) între atomi
Fiecare bordură este o pereche divizată de electroni. În acest caz, moleculele deja cunoscute ne arată așa:
Formulele cu linii între atomi se numesc formule structurale.
Mai des, formulele structurale nu prezintă perechi singulare de electroni
Formulele structurale sunt foarte bune pentru moleculele imagistice: ele arată în mod clar modul în care sunt legate atomii, în ce ordine, prin ce conexiuni.
Perechea de legare a electronilor în formulele Lewis este aceeași cu cea a liniei în formulele structurale.
Dubla și tripla obligațiuni au un nume comun -
De asemenea, se spune că molecula de azot are
egal cu trei. În molecula de oxigen, ordinea obligațiunilor este de două. Ordinea legăturii în moleculele de hidrogen și clor este una. Hidrogenul și clorul nu mai sunt multiple, ci o simplă conexiune.
Ordinea de comunicare este numărul de perechi divizate socializate între doi atomi legați. Ordinea de comunicare de mai sus nu are loc.
Articole similare
Trimiteți-le prietenilor: