Doctor în științe chimice Peter Sergiev, Universitatea de Stat din Moscova. M.V. Lomonosov.
Premiul Nobel pentru Chimie din acest an a fost acordat americanului Tom Staytsu de la Universitatea Yale, savantul britanic Venkatramanu Ramakrishnan de la Laboratorul de Biologie Moleculara din Cambridge, si profesor de la Institutul Weizmann (Israel) Ada Yonath. Acești cercetători au determinat structura ribozomului.



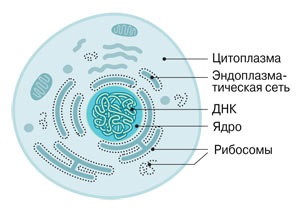
Celula conține zeci de mii de ribozomi cu dimensiunea de aproximativ 25 nm. Unele dintre ele sunt atașate la membranele reticulului endoplasmatic, altele sunt localizate în citoplasmă.
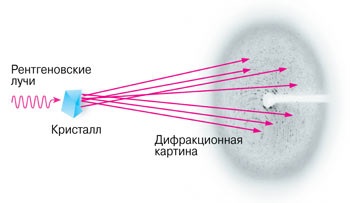
Radiația sincrotronă cu raze X este utilizată pentru cristalografia ribozomilor.
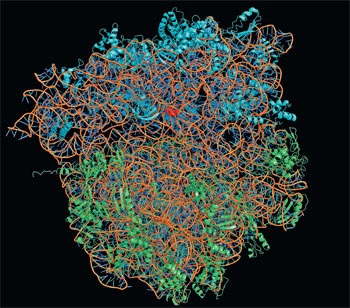
Structura atomică a ribozomului bacterian. Moleculele ARN ribozomale sunt colorate în culoarea portocalie, proteinele subtilurilor mici sunt albastre, proteinele subtipului mare sunt verzi.
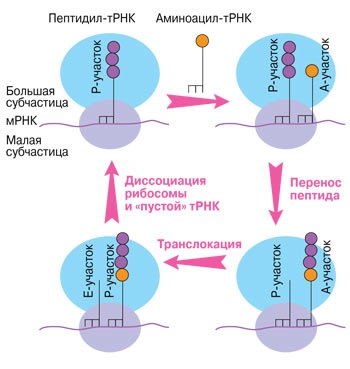
Munca ribosome realizat în mai multe etape: legarea aminoacil-ARNt, transport de peptide din peptidil-ARNt la translocație aminoacil-ARNt (mutarea ARNm de un codon și ARNt de la A-site la site-ul P), de îngrijire „gol“ ARNt.
Ce este un ribozom și cum funcționează? De ce este necesar să o studiem și, în special, de ce a fost atât de important să determinăm structura acestui complex macromolecular imens? Cum poți folosi aceste cunoștințe în practică? Vom încerca să răspundem la aceste întrebări.
Nucleotida și aminoacidul "ALPHABETS"
Probabil că toată lumea a auzit că informațiile despre cum se construiește un organism sunt stocate în ADN - un fel de "bibliotecă" a unei celule vii. Proteinele sunt principalii "lucrători" moleculari din celulă: ei efectuează transformarea substanțelor și energiei, sunt responsabili pentru mișcarea celulei, formează "scheletul", participă la transferul informațiilor ereditare, îndeplinesc multe alte funcții. Pentru viata sa in orice moment, celula foloseste doar o mica parte din informatiile genetice. "Liniile directoare actuale" sunt copiate din secțiuni separate ale ADN-ului sub forma unor "mesaje" scurte - molecule ARNm (ARN-matrice).
Ribosomul - o formă mică intracelulară de formă neregulată, compusă din două "jumătăți" inegale. Ea îndeplinește o funcție foarte importantă: "citește" mesajele mRNA și apoi sintetizează moleculele de proteine prin aceste "mesaje". Acest proces se numește traducere. Problema cu care se confruntă ribozomul este foarte complicată. La urma urmei, proteinele nu constau în nucleotide, ci din alte blocuri fundamentale - aminoacizi. Și sunt doar patru nucleotide și douăzeci de aminoacizi.
Cum se transformă informațiile conținute în cele patru nucleotide într-un cod de aminoacizi? Faptul este că fiecare aminoacid este criptat cu trei "litere" - nucleotide. Din patru litere ale alfabetului de nucleotide este posibil să se facă 64 de cuvinte "cu trei litere" - un codon. Fiecare codon are propriul său aminoacid specific. Deoarece codonii (64) sunt mai mari decât aminoacizii (20), unii aminoacizi sunt codificați prin mai mulți codoni. Pentru descifrarea codului genetic, Marshall Nirenberg, Gobind Koran și Robert Holly au primit premiul Nobel pentru medicină în 1968.
TRANSMISIE ÎN RIBOSOM
Pe ce motive ribozomului recunoaște codonii, ea „își amintește“ orice codon de aminoacid care corespunde? În mod paradoxal, ribozomului în sine nu „știe“ nimic „își amintește“. In celula, exista molecule mici, speciale ARN numite ARNt sau transport, care transporta „pe sine“ și recunosc aminoacizii corespunzători ai codonului aminoacid pe molecula de ARNm. Fiecare ARNt poartă numai „lor“ de aminoacizi. Ideea că ARNt poate fi un fel de „adaptor“ între codonul și de aminoacizi, a fost propusă în anii cincizeci de savantul american, laureat al Premiului Nobel viitor Francis Crick.
Translația informațiilor genetice în ribozomă are loc după cum urmează. Enzimele speciale cu o legătură chimică puternică "coase" cu molecula tARN aminoacidul corespunzător. În acest caz, tARN este pliat într-o structură similară unui bagel sau literei G. La capetele unui astfel de "bagel" există un aminoacid și un așa numit anticodon. Anticodonul recunoaște codonul corespunzător în mARN, dând astfel aminoacidul la locul "asamblare" al moleculei de proteină.
De fapt, tARN-urile servesc ca "traducători" celulari de la "limba" nucleotidelor la aminoacizi. Lucrarea ribozomului este de a selecta o molecula de tRNA corespunzând aminoacidului necesar pentru a construi un lanț proteic la un moment dat. Acest proces de citire a informațiilor se numește decodificare. Ea se realizează de către cele mai mici dintre cele două subcapitole inegale, din care se compune ribozomul. Pe subtitrarea mai mare, aminoacizii sunt reticulați într-un lanț - o nouă moleculă de proteine.
CUM RIBOSOME ESTE DESIGNAT. ÎNCEPÂND CALEA
Cum trateaza ribozomul un numar imens de molecule interactiune si cum este aranjata aceasta planta moleculara? Din punct de vedere chimic, ribozomul este un amestec de ARN și proteine. Se compune din trei soiuri de molecule de ARN, cu numeroase proteine ribozomale asociate cu ARN ribozomal. În bacterii, compoziția unei subtipuri mici include 21 de proteine unice, iar cea mare - 33. Masa totală a unui ribozom este măsurată prin megadaltoni. Spre deosebire de particulele virale comparabile, ribozomul nu are elemente de simetrie, ceea ce face extrem de dificilă studierea structurii sale.
Oamenii de știință au început să investigheze aranjamentul ribozomului pentru o lungă perioadă de timp. La început, în acest scop, sa folosit metoda microscopiei electronice, care a fost aplicată cu succes în URSS de către membru corespondent al Academiei de Științe din Rusia Nikolai Kiselev (Șeful Laboratorului Institutului de Cristalografie,
VA Shubnikov, RAS) și profesorul Viktor Dmitrievich Vasiliev (Institutul de Proteine al Academiei de Științe din Rusia). În prezent, se utilizează o tehnică îmbunătățită, numită microscopie crioelectronică. Cu ajutorul acestei metode, la sfârșitul anilor 1990, cele două laboratoare de frunte, Marina Van Hill din Anglia și Johima Frank în SUA, au depășit limita de rezolvare a puterii a 20 de angstromi. Acum, rezoluția microscopiei crioelectronice se apropie de 5-7 angstromi. A devenit posibilă "vedea" spiralele ARN și domeniile individuale ale proteinelor, dar totuși nu este suficient să înțelegem detaliile structurii ribozomului.
În același timp, continua studiile chimice ale structurii ribozomului. Astfel, în laboratoarele academice Alexei Bogdanov, sub profesorul Olga Anatolevny Dontsova (Departamentul de Chimie MSU) printr-un produs chimic de reticulare a fost definit cu precizie ARNm mediu molecular în ribozom. În Germania, Richard Brimakomb (Institutul de genetica moleculara. Max Planck), compararea rezultatelor microscopie cryoelectron și reticulare chimică, a creat un model al structurii ribozomului, așa cum sa dovedit mai târziu, destul de precisă.
NOBEL RACE PENTRU STRUCTURĂ
De ce este necesar să cunoaștem structura strugurilor
Ei bine, structura ribozomului a fost dificil de determinat. O altă întrebare este dacă acest lucru are sens. Fără îndoială, structura ribozomului nu este doar îmbogățit înțelegerea noastră a interacțiunii dintre ARN si proteine, ea a ridicat această înțelegere la un nou nivel. Acesta a confirmat că ceea ce oamenii de știință au ghicit mult timp: ribozomului nu numai structurale, ci și toate celelalte funcții principale ale ARN-ului. De ce este interesant? Acest lucru demonstrează că ribozomul a venit la noi din proteina, așa-numita ARN-lume.
O lungă perioadă de timp nu a fost clar pentru oamenii de știință cum au apărut mecanismele de transmitere a informațiilor ereditare într-o celulă vie. ADN-ul nu se poate copia, pentru că are nevoie de molecule de proteine. La rândul său, pentru sinteza proteinelor, este necesar ARN-ul care le codifică, care este citit cu ADN, de asemenea, folosind proteine. Ca rezultat, toate cele trei biomolecule de bază se dovedesc a fi relații cauzale înrudite.
ARN-ul idee mondială este că, înainte de orice proteine și ADN-ul mai târziu, și funcția catalitică, și funcția de stocare a informației genetice transportate molecule de ARN. Acum, datorită deschiderii unor noi laureați ai Nobelului, în cele din urmă a fost clar că ribozomul a venit la noi din lumea ARN-ului. De fapt, aspectul său a marcat începutul lumii proteinelor, deoarece ribozomul este o mașină bazată pe ARN pentru producerea de proteine.
Determinarea structurii unui ribozom cu rezoluție atomică reprezintă o descoperire necondiționată în domeniul științei fundamentale, precum și o oportunitate unică de a proiecta și crea noi preparate medicinale. Se poate admira din nou această realizare a laureaților de la Nobel și le dorim să le descoperim în continuare.
LUCRAREA RIBOZOMELOR: DE LA TRADUCERE LA TRADUCERE
Mecanismul de traducere este destul de complicat. Pe scurt, în timpul funcționării ribozom ARNt trece prin diferența dintre cele două subunități ribozomale care intră succesiv în trei ARNt obligatorii „buzunar“. În primul „buzunar“ (A situs) se leagă ARNt complex și aminoacizi (aminoacil-ARNt), al doilea „buzunar“ (R-porțiune) este ARNt la ribozom a venit la citirea codonul precedent (peptidil-ARNt). Acest tARN este asociat nu numai cu "propriul" aminoacid, dar și cu întreaga moleculă de proteine sintetizată în momentul de față. De fapt, lanțul de aminoacizi reticulare proces este transferul peptidei în formare de ARNt la aceasta tocmai a sosit pentru prima „buzunar“ al ARNt complex cu un aminoacid. În acest caz, tARN nou sosit se alătură întregii proteine sintetizate de ribozom. ARNm care transporta molecula de proteine devine "gol".
Articole similare
Trimiteți-le prietenilor: