Un echivalent chimic este o cantitate care combină cu 1 mol de atomi de hidrogen sau înlocuiește același număr de atomi de hidrogen în reacțiile chimice. De exemplu, în HCI, H2S, NH3. Echivalentul CH4 al clorului, sulfului, azotului, carbonului este egal cu 1 mol, 1/2 mol, 1/3 mol, respectiv 1/4 mol.
Masa echivalentă este masa de 1 echivalent substanță (g / mol). In exemplele de mai sus greutate echivalentă de clor, sulf, azot și carbon sunt, respectiv 35,45 g / mol, 32/2 = 16 g / mol, 14/3 = 4,67 g / mol, 12/4 = 3 g / mol .
Valoarea masei echivalente a unui element este determinată de ecuația:
E este masa echivalentă a elementului;
A este masa atomică a elementului;
B este valența elementului din compusul dat.
De exemplu, EA1 în Al2O3 este 27/3 = 9 g / mol; ECa în CaS04 este 40,08 / 2 = 20,04 g / mol.
Rezultă din ecuația (1) că, spre deosebire de masa atomică sau molară, masa echivalentă nu este o constantă, ci depinde de valența elementului. Valorile constante ale masei echivalente pot fi numai pentru elementele cu valență constantă.
Conceptul de mase echivalente și echivalente se extinde la substanțe complexe.
Un echivalent al unei substanțe complexe este cantitatea sa care interacționează fără reziduuri cu un echivalent de hidrogen sau cu un echivalent al oricărei alte substanțe.
Masa echivalentă a unei substanțe se calculează pe baza masei sale moleculare:
M este masa molară.
Baza acidului este determinată de numărul de atomi de hidrogen pe care o produce molecula de acid, reacționând cu baza.
Aciditatea bazei este determinată de numărul de protoni atașați la molecula de bază atunci când interacționează cu acidul.
Ca și masa echivalentă a unui element, masa echivalentă a unei substanțe complexe poate avea mai multe valori, în funcție de reacția în care substanțele participă.
De exemplu, în reacție:
Masa echivalentă a acidului este egală cu masa molară a acestuia:
Masele de substanțe care interacționează unul cu celălalt sunt proporționale cu masele lor echivalente (echivalente):
mA și mB sunt masele substanțelor care interacționează A și B;
EA și EB sunt mase echivalente ale acestor substanțe.
Ecuația (2) este expresia matematică a legii echivalente.
Scopul lucrării este de a determina masa echivalentă de magneziu. Experimentul se efectuează pe o instalație, schema din care este prezentată în figura de mai jos.
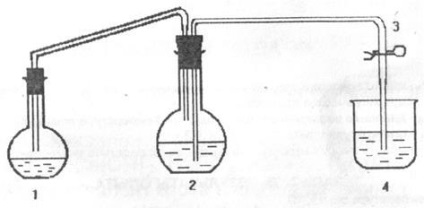
unde, balonul de reacție; 2 - balon rotund cu fund plat; 3 - clemă; 4 - sticlă.
ORDINEA DE PERFORMANȚĂ
1. Se cântăresc pe scale tehnice aproximativ 0,1 g de magneziu până la 0,01 g.
2. Asamblați instalația.
3. Se toarnă aproximativ 25-30 ml în vasul (1). acid sulfuric diluat. Ștergeți peretele intern al gâtului balonului cu o hârtie de filtru până se usucă.
4. Umpleți flaconul (2) cu 3/4 din volum cu apă și închideți-l cu dop cu țevi de scurgere. Prin suflarea aerului printr-un tub scurt, umpleți apa cu un tub lung și fixați clema (3). Asigurați-vă că clema este apăsată.
5. Se toarnă 50 cm 3 de apă în paharul (4) și se scurge o conductă de ramură lungă de la becul (2) în acesta.
6. Puneți balonul (1) într-o poziție orizontală și turnați cantitatea de magneziu suspendată pe peretele uscat al gâtului (metalul nu trebuie să intre în acid!).
7. Închideți flaconul (1) cu un dop, cu un tub scurt de descărcare și cu flacoane (2). Închideți ar trebui să fie atent și cu atenție. Balonul ar trebui să fie ținut de gât, plută trebuie închis ușor și treptat, rotind ușor. (Este necesar să aveți grijă ca magneziul să intre în ACID!).
8. Așezați flaconul (1) în poziție verticală, deschideți simultan clema (3) și lăsați-o deschisă.
9. Se observă interacțiunea magneziului cu deplasarea acidă și hidrogen a apei din balonul (2) în paharul 4.
10. Atunci când tot magneziul reacționează cu un acid pentru a fixa clema (3) este eliminat din tubul de evacuare din sticlă (4) și se măsoară cantitatea de apă într-un cilindru de sticlă.
11. Din volumul obținut, se scade 50 cm3 (adică cantitatea de apă care a fost turnată în sticlă înainte de experiment).
12. Diferența va fi egală cu volumul de hidrogen extras V1
1. Scrieți ecuația reacției de interacțiune dintre magneziu și acid sulfuric diluat.
2. Pentru a aduce volumul de hidrogen (V1) găsit în condiții normale prin formula:
V0 este volumul de hidrogen în condiții normale, cm3;
P - presiunea barometrică, kPa;
Pv este presiunea saturată a vaporilor de apă la temperatura experimentală, kPa;
T1 este temperatura experimentului, K. T1 = 273 + t.
3. Se calculează masa hidrogenului deplasat, se determină masa echivalentă de magneziu.
Temperatura experimentală, ° C -
Presiunea barometrică, kPa -
Greutate de magneziu, g -
Presiunea vaporilor saturați de apă, kPa -
Volumul de hidrogen în condițiile experimentale, cm3 -
Masa hidrogenului, g -
Greutatea echivalentă a magneziului, g / mol-
Presiunea de vapori de apă saturată la temperaturi diferite
Prin volum, deplasat în condiții normale de hidrogen (V0), se calculează masa volumului. Având în vedere că masa de hidrogen de 22,4 litri în condiții normale (nu) cântărește 2 g, se găsește masa de H2.
22,4 H2 cântărește 2,0 g.
Conform masei cunoscute de magneziu consumat (mMg) și hidrogenul deplasat de acesta, se determină masa echivalentă de magneziu:
Rezultatul este comparat cu masa echivalentă, calculată prin formula:
A este masa atomică a metalului; B este valența metalului.
3. Cât de mult se obține oxidul prin oxidarea a 3 g de metal, a cărui masă echivalentă este egală cu 9 g / mol.
4. Determinați greutățile echivalente ale acizilor și bazelor:
5. Cât va dura la n. masa unui echivalent de oxigen și hidrogen.
6. Se determină echivalentul metalului, dacă 0,046 g din acesta este deplasat din acidul 62,35 ml H2 la t = 17 ° C și presiunea 1,017 x 105 Pa. Presiunea vaporilor de apă la 17 ° C este de 0,193 x 105 Pa.
7. Se calculează: a) masa echivalentă a staniu, dacă, în timpul încălzirii 0,92 g din acesta în curentul de oxigen, se formează 1,17 g de oxid de staniu;
b) magneziu, dacă este încălzit de un curent de oxigen, masa sa a crescut cu 66,7%.
8. Se calculează echivalentul acidului sulfuric în reacția cu KOH:
9. Calculați echivalentul Ca (OH) 2 și H3P04. Calculați câte grame de Ca (OH) 2 vor fi necesare pentru a neutraliza 150 g de H3PO4
Lucrarea de laborator № 3
Articole similare
Trimiteți-le prietenilor: