Azotul formează un număr de oxizi, care corespunde tuturor posibile stări de oxidare formală de 1 la 5: N2 O, NO, N2 O3. NO2. N2O5. dar numai două dintre ele - oxidul de azot (II) și oxid de azot (IV) - nu numai stabil în condiții normale, dar este implicat activ în ciclu natural și industrial azot.
1.2.1 Unii compuși de azot și proprietățile lor
Oxizi de azot
N2 + 1 O - oxid de azot (I), oxid de azot, gaz "distractiv", oxid non-sare. N2O se obține prin descompunerea azotatului de amoniu:
N2 O are un miros slab plăcut și un gust dulce. Cu oxigen, apă, soluții de acizi și alcalii nu reacționează. Se descompune în elemente la temperaturi de peste 500 ° C, cu alte cuvinte, este suficient de stabilă.
Structura: oxigen 2 electroni neparticipati, azot 3 - formau o legatura dubla si un electron neparticipat in restul. Se poate presupune că moleculele NO se vor împerechea și vor forma o moleculă dimerică ONNO. Structura moleculară: liniară moleculă O = N = N, în care atomul central de N este tetravalent. Se formează două legături duble: una - cu oxigen la schema tipică a crea legături covalente (doi electroni azot, doi electroni de oxigen), iar cealaltă - cu atomul de azot (care două dintre cele trei perechi sale de electroni nepereche și formând astfel un gol orbital) unul a legăturilor covalente, al doilea donor-acceptor (figura 1). Aparat pentru producerea unui oxid de azot (I) este format din suporturi, eprubete, tuburi cu o conductă de evacuare a gazelor, cilindrul de turnare și o lampă de spirit (Fig. 2). NH4N03 este introdus în tub. închideți ștecherul cu un tub de evacuare a gazului și încălziți. Gazul este colectat într-un cilindru umplut cu apă.
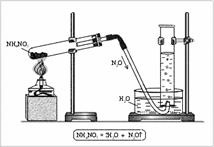

Fig. 2. Obținerea oxidului de azot (I) în laborator
Oxidul de N2O se descompune la încălzire:
Oxidul de N2O reacționează cu hidrogen:
N + 20 - oxid de azot (II). oxidul care nu formează sare. NO se obține prin reacția cuprului cu un acid HNO3 (decib.) (Figura 3).
Grâul de cristal este molecular; molecula este ușoară, slab polară (electronegativitatea oxigenului este puțin mai mare decât cea a azotului). Se poate presupune că punctele de topire și punctele de fierbere sunt scăzute, dar mai mare decât cea a azotului, adică. K. polaritatea moleculelor face posibilă conectarea forța electrostatică de atracție a forțelor pur și simplu intermoleculare. Formarea unui dimer promovează de asemenea o creștere a punctului de fierbere. Structura moleculei sugerează o solubilitate scăzută în apă. Oxidul nitric (II) nu are nici culoare, nici miros.
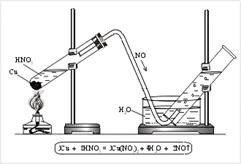

Fig. 3. Obținerea de oxid nitric (II) în laborator
Pentru obținerea oxidului de azot (II), se introduc mici picături de cupru în tub și se toarnă acidul azotic diluat. Tubul este închis cu o plută cu un tub de evacuare a gazului și este întărit într-un trepied. Capătul tubului de evacuare a gazului este coborât în cristal cu apă și apoi în cilindru (Figura 3). Când este încălzit, se eliberează NO. NO este ușor oxidat de oxigenul din aer, adică acționează ca agent reducător:
În reacția cu dioxid de sulf, agentul oxidant:
N + 22O3 - oxid nitric (III). anhidrida anhidră (corespunde acidului azotic HNO2 și sărurilor de nitrit); este un oxid acid, se caracterizează prin toate proprietățile oxizilor acide. Oxidul N2O3 se obține prin reacția:
Să considerăm electronii de azot din molecula NO. Acest electron nepereche, o pereche liberă de electroni și încă doi electroni în legătură cu oxigenul - doar cinci. Și atomul de oxigen "ieșind pe legătură", șase electroni în patru orbite. Dacă sunt aranjate în două, atunci o orbită va rămâne liberă. Acesta este cel ocupat de perechea de electroni ai atomului de azot (figurile 4, 5).
Fig. 4. Schema structurii electronice a moleculei NO2 (prima versiune). (Punctele denotă electronii atomilor de O, crucile reprezintă electronii atomului de N)
Fig. 5. Schema structurii electronice a moleculei NO2 (a doua opțiune). (Asteriscul denotă atomul O excitat, săgeata indică legătura donor-acceptor.
Odată ce o pereche de electroni localizate pe s-orbitalii "s-au dus la o conexiune", pur și simplu trebuie să treacă prin hibridizare. Se pune întrebarea: ce tip de hibridizare utilizează un atom? Răspuns: trei orbite electronice de azot sunt în stare de sp2-hibridizare. Molecula de NO2 este unghiulară, cu un unghi de 134 ° (un unghi mai mare de 120 °, deoarece un electron respinge electronii de comunicare mai slabi decât o pereche de electroni) (fig.6, 7).
Cu toate acestea, rețeaua cristalină este moleculară, deoarece molecula însăși este mai grea decât NO și tendința spre dimerizare este mult mai mare, trebuie să se topească și să fiarbă la temperaturi semnificativ mai ridicate. Punctul de fierbere este de 21 ° C, deci în condiții normale - 20 ° C și 760 mm Hg. Art. - Oxidul nitric (IV) este lichid.
Oxidul de azot (IV) se dizolvă în apă, reacționând simultan cu acesta și, în același timp, se produc doi acizi.
Fig. 7. Molecula de NO2 este o vedere "laterală", din partea legăturii donor-acceptor. (Cel de-al doilea atom de oxigen nu este vizibil dincolo de orbitele atomului de azot. Cercurile umbrite sunt orbitali hibridizați de atomi direcționați către cititor.)
Oxidul nitric (IV) are un miros caracteristic ascuțit și o culoare maro-rugină, ale căror nuanțe diferă în funcție de concentrație. Pentru această culoare, emisiile de oxizi de azot în atmosferă sunt numite "cozi vulpe" [4].
3) Dimerizarea în timpul răcirii:
La o temperatură de -11 ° C, echilibrul este complet deplasat spre dreapta și la +140 ° C complet în stânga.
1.2.1.2 Acidul nitric
Din hidroxizii azotului vom lua în considerare acidul azotic cu cel mai mare tonaj.
Molecula acidului azotic este polară (datorită electronegativității diferite a oxigenului și a hidrogenului, deoarece azotul este ascuns în interiorul moleculei) și asimetric. Toate cele trei unghiuri dintre legăturile de azot și oxigen sunt diferite. Gradul oficial de oxidare a azotului este mai mare (+5). Dar în acest caz doar 4 legături între atomul de azot și alți atomi - valența azotului este de 4.
Structura unei molecule este mai ușor de înțeles dacă luăm în considerare procesul de obținere a acesteia. Acidul azotic este produs prin reacția oxidului nitric (IV) cu apă (în prezența oxigenului): două molecule NO2 simultan „atac“ molecula de apă cu electroni nepereche, rezultând legăturii de hidrogen și oxigen este rupt, nu ca de obicei (pereche de electroni pe oxigen și „proton goale "), Și o moleculă de NO2 devine hidrogen cu electronul său, iar celălalt - radical OH (figura 8). Formată doi acizi: ambii acizi puternici, ambele dau rapid protoni mai apropiate moleculele de apă și sunt rezumate în formă de ioni NO2 - și NO3 -. Ionul de NO2 este instabil, două molecule de HNO2 se descompun în apă, NO2 și NO. Oxidul NO reacționează cu oxigenul, transformându-se în NO2. și așa mai departe, până când veți obține numai acid azotic.
Fig. 8. Schema formării moleculelor de acizi azotați și azotați. (O minge neagra este un atom de N, bilele albe mari sunt atomi de O, bilele albe mici sunt atomi H)
Formal, se pare că un atom de oxigen legat la atomul de azot al unei duble legături, iar cealaltă - legătura simplă convențional (acest atom de oxigen, de asemenea, conectat la un atom de hidrogen). Cu al treilea atom de oxigen legat de atomul de azot din HNO3 legătură donor-acceptor, și servește ca un atom de azot donor. Hibridizarea cu atomul de azot trebuie să fie sp 2 datorită prezenței unei duble legături, care definește structura - un triunghi plat. De fapt, se pare că, într-adevăr, un fragment din atomii de azot și trei atomi de oxigen - un triunghi plat, doar într-o moleculă de acid azotic acest triunghi incorect - ONO toate cele trei unghiuri sunt diferite, prin urmare, diferite laturi ale triunghiului. Când molecula disociază, triunghiul devine regulat, echilateral. Prin urmare, atomii de oxigen din el devin echivalenți. Toate link-urile devin aceleași.
Proprietățile fizice ale acidului azotic
Compusul ionizat, chiar dacă este parțial, este dificil de convertit la gaz. Astfel, temperatura de fierbere ar trebui să fie suficient de mare, dar la o astfel de temperatură ridicată de topire cu greutate moleculară mică, nu ar trebui să fie. În consecință, starea agregată la 20 ° C este lichidă. În ceea ce privește solubilitatea, ca multe alte lichide poliare, acidul azotic este ușor de amestecat cu apă în orice proporție. Acidul acid azotic este incolor și inodor. Cu toate acestea, datorită descompunerii în oxigen și oxid de azot (IV), care este dizolvat, și se poate spune că acidul azotic concentrat convențional are o culoare galben-brun și o caracteristică NO2 miros înțepător. Să vedem cum structura moleculei de acid azotic afectează proprietățile sale chimice.
HNO3 - oxidant puternic
Când HNO3 interacționează cu metalele (M), hidrogenul nu este eliberat:
Sare M + HN03 + apă + gaz.
Un amestec de HNO3 (conc.) Cu HCI (conc.) Într-un raport de volum de 1: 3 (HV03 HV + 3V HCI) se numește "vodka regală".
Acidul azotic nu reacționează cu alți acizi prin tipul de schimb sau de reacții compuse. Cu toate acestea, este pe deplin capabil să reacționeze ca un oxidant puternic. Într-un amestec de azot concentrat și acizi clorhidrici, apar reacții reversibile, esența cărora poate fi generalizată prin ecuația:
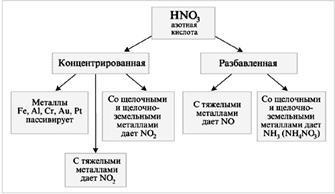

Clorul atomic rezultat este foarte activ și selectează cu ușurință electroni de la atomii de metal și ionul de clor formează ioni complexi stabili cu ionii metalici care rezultă. Toate acestea fac posibilă transferarea chiar și aurului în soluție. H2SO4 concentrat ca agent puternic de deshidratare promovează reacția de descompunere a acidului azotic la oxidul de azot (IV) și oxigenul. Acidul azotic este unul dintre cei mai puternici acizi anorganici și, în mod firesc, reacționează cu alcalii. Reacționează de asemenea cu hidroxizi insolubili și cu oxizi de bază [4].
Când studiază tema "Azot. Compuși de azot "utilizează un manual de chimie editat de G.E. Rudzitis, F.G. Feldman, de asemenea un manual pentru gradul 9, editat de N.S. Ahmetov. Materialul didactic este o carte despre chimie pentru clasele 8-9 editată de AM Radetsky, VP Gorshkov; Sarcinile pentru roboți independenți în chimie pentru clasa 9 sunt editate de R.P. Surovtseva, S.V. Sofronova; O colecție de probleme în chimie pentru școala secundară și pentru solicitanții la universități sub ediția lui G.P. Khomchenko, I.G. Khomchenko. Studiul acestui subiect durează 7 ore [3, 5].
Du-te la descărcarea fișierului
Articole similare
-
Sinopsisul nodurilor din grupul pregătitor "Observarea comparativă a ramurilor de molid și pin"
-
Ca pe site-uri de ucoz pentru a împărți materialele în grupuri, pas pentru început
Trimiteți-le prietenilor: