Apa are multe proprietăți uimitoare care o deosebesc de alte substanțe. Datorită acestor proprietăți unice ale apei, viața, așa cum o știm, poate exista pe Pământ.
Aproximativ 70% din masa corpului nostru constă în apă. În ciuda faptului că molecula de apă poate părea relativ simplă și ușoară, funcțiile sale sunt complexe și multilaterale. Alte substanțe nu prezintă astfel de proprietăți.
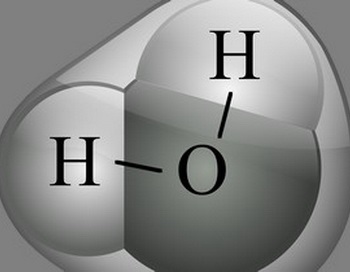
Molecula de apă, cunoscută sub numele de formula H2O, constă dintr-un atom de oxigen și doi atomi de hidrogen, fiecare dintre aceștia fiind atașat la oxigen. Ca urmare a forței electromagnetice dintre molecule, molecula este cea mai echilibrată și mai stabilă formă: un triunghi. La baza ei sunt doi atomi de hidrogen, iar la partea de sus este un atom de oxigen. Ceea ce interesează în această structură și ce afectează proprietățile moleculei este încărcarea electrică necorespunzătoare. Vârful triunghiului în care este localizat atomul de oxigen este încărcat negativ, adică există mai mulți electroni. Baza triunghiului, unde există doi atomi de hidrogen, este încărcată pozitiv. Astfel, se obține o moleculă cu o sarcină electrică diferită la capete. Această structură permite acestei molecule să reacționeze cu câmpurile electrice din jurul acesteia.
În plus față de compușii chimici, există încă legături într-o singură moleculă în stare solidă și lichidă. Datorită structurii caracteristice a dipolului, în care distribuția încărcăturii electrice nu este uniformă, moleculele de apă sunt conectate de obicei atunci când un atom de oxigen (cu o sarcină negativă) este atașat la un atom de hidrogen (cu o sarcină pozitivă).
În starea lichidă a apei, intervalele de timp ale compușilor de hidrogen sunt mult mai scurte decât am folosit. Aceștia ocupă o treime de secundă.
Din punctul nostru de vedere, moleculele formează și rup legăturile cu viteză fantastică. Dar, probabil din punctul de vedere al acestor particule minuscule, acestea sunt intervale normale. Se pare că și durata de viață a unei molecule este foarte scurtă. Atomii de hidrogen trec de la moleculă la moleculă, astfel încât durata medie de viață a unei molecule de apă este măsurată în milisecunde.
Deși această moleculă triunghiulară pare simplă și nevinovată, legăturile cu hidrogen creează proprietăți complexe, în afara căii. Este interesant să observați cum aceste proprietăți ale apei se încadrează în mediul nostru. Și, nu este deloc clar dacă viața, pe care o știm, ar fi putut să supraviețuiască și chiar să prospere.
Una dintre caracteristicile neașteptate ale apei este punctul ei de fierbere și punctul de topire. Potrivit cercetătorilor, ținând cont de masa moleculei, punctul de topire al apei ar trebui să fie de minus 100 de grade, iar punctul de fierbere este de minus 50 de grade Celsius, ceea ce este mult mai mic decât știm. Acest fenomen neobișnuit este explicat prin multitudinea de legături de hidrogen care caracterizează molecula de apă și le unesc unul cu altul. Datorită acestui fapt, suprafața globului este acoperită de oceanele din lume cu 70%. Dacă luăm în considerare această problemă din punctul de vedere al existenței vieții pe Pământ, ar putea exista viața dacă apa ar fi fierbată deja la o temperatură de minus 50 de grade?
Când apa cristalizează în gheață, legăturile de hidrogen se stabilizează și astfel mișcarea dintre molecule este suspendată și distanțele dintre ele rămân. În acest caz, atunci când legătura de hidrogen este neschimbată, moleculele de apă se confruntă cu distanța dintre ele relativ mare și se formează un cristal cu densitate scăzută, în comparație cu apa în stare lichidă. Deci, o proprietate neobișnuită a apei este dezvăluită - în stare lichidă este mai densă și mai grea, prin urmare, gheața este mai ușoară decât apa și plutește pe suprafața sa, spre deosebire de alte substanțe care sunt mai grele, mai grele decât lichid. Imaginați-vă cum ar arăta lumea noastră dacă gheața sa scufundat până la fundul mării ...
Și un mic detaliu: mărimea mică a moleculei de apă și polaritatea acesteia, o ajută să servească ca un excelent solvent - o altă trăsătură care este baza pentru menținerea formei eficiente a vieții care ne este cunoscută.
În ultimii ani, au fost expuse diferite laboratoare din întreaga lume, provocând și mai multă curiozitate, trăsături intrigante ale apei, demonstrând cât de mult este sub influența mediului și, probabil, la rândul său, afectează și ea. De data aceasta ne-am concentrat doar pe o parte din caracteristicile neobișnuite ale apei, care permit vieții pe planeta noastră să fie ceea ce este și să ofere condițiile necesare existenței noastre fizice.
În următoarea parte a articolului, vă vom oferi un studiu al studiilor care demonstrează modul în care gândurile noastre afectează apa.
Versiunea ebraică
Articole similare
Trimiteți-le prietenilor: