Procesul de dizolvare a IUD continuă spontan, dar pentru o lungă perioadă de timp, și este adesea precedat de umflarea polimerului în solvent.
Polimerii, ale căror macromolecule au o formă simetrică, pot trece în soluție, fără pre-umflare. De exemplu, hemoglobina, glicogen hepatic în timpul dizolvării cu greu se umfla, iar soluțiile acestor substanțe nu au o viscozitate ridicată chiar și la Cf.-tively concentrații mari, în timp ce substanțele a căror molecule asimetrice extinse prin dizolvarea foarte mult umfla (gelatină, celuloză, cauciuc natural și sintetic).
Umflarea este o creștere a masei și a volumului polimerului datorită penetrării moleculelor de solvent în structura spațială a DIU.
Motivul pentru umflare este o mare diferență în mărimea moleculelor solutului și solventului și, ca o consecință, diferența mare în ratele de difuzie a acestora. Atunci când se produce umflarea primei schi-verso Difuziunea practică a moleculelor de solvent în pro-mesh definiția spațială a polimerului având aceeași natură ca și osmoza solventului în celula osmotic prin porii membranei semipermeabile.
Mecanismul de umflare reduce la pătrunderea moleculelor de solvent în straturile cele mai apropiate ale polimerului și solvația secțiunilor corespunzătoare din lanțul polimeric. Ca rezultat, macromoleculele "se desfac", ceea ce facilitează penetrarea în continuare a moleculelor de solvenți și o creștere a masei și a volumului polimerului.
Două tipuri de umflare: nelimitat, GOALĂ-vayuscheesya dizolvarea completă a DIU (de exemplu, umflarea gelatina în apă, cauciuc în benzen, nitroceluloză aceto-nu) și limitată, ceea ce conduce la formarea de polimer umflate - jeleu (de exemplu, umflarea celuloză în apă, gelatine în apă rece, cauciuc vulcanizat în benzen). Studen este o rețea spațială constând din macromolecule interconectate ale polimerului și umplute cu molecule de solvent.
Gradul de umflare și a limitărilor de proces POSIBILITATEA dizolvării spontane determinate de energia legăturii X-relație în rețeaua polimerică și energia Solva-punerea lanțului polimeric cu factorul de entropie.
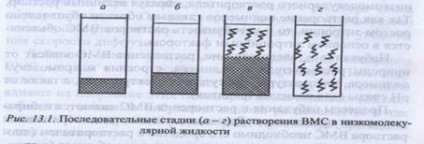
Întregul proces de umflare și dizolvare a IUS poate fi împărțit condiționat într-un număr de etape: (Figura 1).
1. În etapa inițială (figura 1, a), sistemul constă din două componente: un polimer și un lichid cu greutate moleculară mică.
2. A-tranziția a - »6 este caracterizată prin penetrarea intensivă a moleculelor unui lichid molecular scăzut în structura polimerului și solvarea lanțului polimerului, însoțită de evoluția căldurii (# 916; H <0). Изменение энтропии по сравнению с энтальпийным фактором незначительно. При этом объем полимера возрастает, но общий объем системы «полимер-растворитель» уменьшается. Это явление называется кон-тракцией, а выделение теплоты говорит о физико-химической природе процесса.
3. Tranziția 6 -> 6 reprezintă etapa inițială a distribuției macromoleculelor de polimer în întregul volum al solventului și se caracterizează printr-o creștere a entropiei sistemului ca urmare a creșterii numărului de posibile conformații. Entalpia sistemului, dacă se schimbă, este nesemnificativă.
În această etapă are loc, de obicei, creștere majoră a volumului și a masei este Limeray care este rezultatul penetrării-continuare a moleculelor de solvent în rețeaua de polimer, care se dezintegrează stabilit și eliberarea parțială asociată macromoleculelor de molecule. Macromoleculele individuale încep să se desprindă unul de altul și trec într-un strat de lichid cu greutate moleculară mică. Limita de umflare se încheie în etapa b sau în formarea de jeleu. Dezvoltarea ulterioară a procesului - umflare nelimitată - conduce la dizolvarea polimerului, adică la formarea unei soluții de DIU.
4. Tranziția la -> r apare ca rezultat al forțelor de difuzie și se caracterizează printr-o creștere semnificativă a entropiei sistemului. În acest caz, moleculele macro BMC sunt distribuite uniform pe întregul volum al solventului molecular scăzut, formând o soluție adevărată.
Deoarece dizolvarea polimerilor se datorează în principal creșterii entropiei, stabilitatea soluțiilor UI se explică în principal prin factorul de entropie.
Umflarea și dizolvarea DIU depind de:
1. Natura solventului și a polimerului,
2. Structura macromoleculelor polimerice,
4. prezența electroliților,
5. pH-ul mediului (pentru polielectroliți).
Procesele de umflare și dizolvare, DIU, sunt procese selective. Pentru a forma o soluție a IUS, este necesară afinitatea sa pentru solvent (liofilicitate). Polimerii nepolari se umflă bine (se dizolvă) în solvenți nepolari (cauciuc în benzen sau benzină) și nu se umflă în polar. Polimerii polari se umflă mai bine (se dizolvă) în lichide polare (proteine în apă) și nu se umflă în nepolar.
Datorită afinității polimerului cu solventul pentru umflare și dizolvare, cea mai mare parte a solventului se "leagă" la solvat (hidrat). Aceasta este în mod caracteristic caracteristică macromoleculelor polare într-un mediu apos. Și deoarece macromoleculele au o suprafață mare, pentru o umflare (dizolvare) nelimitată chiar și într-un sistem liofilic, este necesară o cantitate suficientă de lichid. În caz contrar, procesul de umflare se poate opri în stadiul de inflamare limitată, i. E. de formare de jeleu.
Structura moleculelor de polimeri macro joacă un rol important în umflarea. De exemplu, polimerii cu lanțuri rigide lungi și un număr mare de grupuri polare se umflă bine, dar nu se dizolvă nici măcar în solventul corespunzător (celuloza în apă). Dacă polimerul se dizolvă în lichid nu este suficient de bun, atunci se formează gelatină.
Temperatura influențează aceste procese în conformitate cu principiul Le Chatelier. Deoarece umflarea este însoțită de o eliberare de căldură în prima etapă, atunci cu creșterea temperaturii, gradul de umflare, precum și solubilitatea dimerului, scad. În a doua etapă, umflarea poate deveni un proces endotermic. În consecință, în acest caz, umflarea crește odată cu creșterea temperaturii.
De exemplu, dacă în apă rece gelatina se umflă excesiv, atunci cu temperatură în creștere este nelimitată, adică se dizolvă. După răcirea soluției rezultate, se formează din nou gelatină. Cu toate acestea, rata de umflare (dizolvare) a polimerilor crește odată cu creșterea temperaturii datorită creșterii ratei de difuzie.
Efectul ionilor de electroliți asupra umflării IUD polar este legat de capacitatea lor de hidratare. Deoarece anionii sunt hidrați mai mult decât cationii, cationii afectează în mod nemodificat umflarea acestor polimeri.
Prin capacitatea de a reduce anionii de umflare se află în așa-numitele serii lyotropice sau în seria Hofmeister (cu același cation): CNS -
Iones CNS - crește umflarea datorită faptului că, ușor hidratate, ele sunt bine adsorbite pe macromoleculele IUS. A SO4 2- ioni inhiba procesul de îmbibare, deoarece ionii sulfat ai tuturor anionilor puternici această serie ruyutsya-hidrat, scăzând astfel cantitatea de „libere“ (nu este conectat în coajă hidrat clorhidric) apă.
Influența pH-ului mediului este deosebit de importantă pentru electroliții cu înaltă moleculară (proteine, acizi nucleici, derivați de celuloză și amidon). Umflarea minimă este observată în EIE, deoarece în ea încărcătura electrică totală a macromoleculelor proteice și, respectiv, gradul de hidratare a acestora este minim. La valori mai scăzute sau mai ridicate ale pH-ului, ionizarea grupărilor funcționale crește, ceea ce duce la repulsia secțiunilor încărcate cu același nume ale lanțului polimeric și la slăbirea acestuia. Ca urmare, moleculele de apă pătrund mai ușor în spațiul dintre lanțuri, ceea ce reflectă umflarea în direcția creșterii sale.
Caracteristica cantitativă a umflării limitate a polimerilor este gradul de umflare # 945;. determinată de raportul dintre creșterea incrementului de masă (m - m0) sau volumul (V - V0) al polimerului la masa inițială, apoi (volumul V0):
unde m este masa (volumul V) a polimerului umflat.
Umflarea polimerilor este însoțită de apariția presiunii, numită presiunea de umflare (≈ 5 # 8729; 10 5 -10 # 8729; 10 5 Pa). Mecanismul apariției acestuia este similar cu mecanismul presiunii osmotice. Această presiune este detectată cu ușurință atunci când un obstacol împiedică creșterea volumului polimerului.
Articole similare
Trimiteți-le prietenilor: