Produsele de prelucrare a concentratelor de litiu sunt sărurile de litiu (carbonat, sulfat, clorură) și hidroxid. Nai produs final mai raspandit - carbonat de litiu, care este materia primă pentru prepararea altor compuși, în particular clorura de litiu, din care litiul metalic pro-plumb.
În practica industrială se utilizează în mod predominant trei metode de descompunere a concentratelor de litiu: acid sulfuric, sulfat (sinterizare cu K2S04) și calcar. În plus, uneori se utilizează metoda de clorură de calciu.
Descompunerea cu acid sulfuric este folosită pentru concentratele de litiu de toate tipurile: spodumena, lepidolitul și ambligonitul. Ca rezultat al descompunerii concentratului cu acid sulfuric concentrat la temperatura de 200-250 ° C și apoi prin scurgerea ulterioară a produsului cu apă, se obțin soluții care conțin sulfat de litiu din care se precipită carbonatul de litiu.
Prelucrarea spodumenelor. Pentru acidul sulfuric eficient descompunerea spodumene necesară procesarea inițială-ter nomice acesta la aproximativ 1100 ° C pentru conversia a-TION - 3-spodumene / (a - spodumene greu descompunându acid sulfuric etsya.). Arderea se face într-un cuptor cu tambur. Element de interacțiune cu acid sulfuric / 3- spodumene constă în înlocuirea cationilor litiu cu acid protoni păstrând structura / 3-spodumene:
Li20 • A1203 • 4Si02 + H2S04 Li2S04 + H2O *
* A1203 • 4Si02. (10.1)
Deoarece siliciul și aluminiul rămân în aceeași rețea de silicat de aluminiu, litiul este extras selectiv într-o soluție apoasă, care prin urmare conține puțin impurități.
Concentratul acid sulfuric și se amestecă într-un șurub care livrează amestecul în cuptorul rotativ (un tambur de oțel neacoperit) în cazul în care la 250 ° C rapid (10 - 15 minute) încasările sulfatization.
Materialul sulfat este spălat cu apă, cretând hrana în reactor pentru a neutraliza excesul de acid sulfuric (până la pH = 6 + 6,5). Soluția filtrată este purificată din magneziu prin neutralizare cu var (pH = 12 + 14) și apoi prin calciul prin precipitare cu sare de CaCO3.
Impuritățile de precipitat de fier și aluminiu sub formă de hidroxizi la pH = 7, în timp ce soluția este evaporată simultan la o concentrație de Li2SO4 de 200 g / l.
După separarea precipitatului prin filtrare, carbonatul de litiu este precipitat din soluție cu o soluție saturată de sodă. Sedimentele spălate conțin 96-97% Li2C03. Recuperarea în carbonat de la spodumen concentrat este de 85-90%.
Prelucrarea lepidolitului. Lepidolitul poate fi sulfatat direct cu acid sulfuric la 320-330 ° C. Pentru a accelera procesul utilizat uneori preliminar Pla fenomen lepidolite la 1090 ° C, transformându-l într-o masă diferit sticloasă care după măcinare sulphatization.
Soluțiile de acid sulfuric obținute în timpul procesării lepidolitului conțin Li2S04, K2S04, Na2S04, Al2 (SO4) 3.
Majoritatea aluminiului este izolată de obicei sub formă de alum de potasiu K [A1 (SO4) 2] • 12H20, răcirea soluțiilor la -5
0 ° C (la soluție se adaugă sulfat de potasiu). În plus, alumina este recuperată din soluția neutralizată în compoziția A1 (OH) 3. În timpul evaporării ulterioare a soluției, o parte din K2S04 și Na2S04 cristalizează. Soluția filtrată este precipitată din carbonat de litiu.
Metoda se bazează pe sinterizarea concentratelor de litiu cu sulfat de potasiu, urmată de lăcrierea sinterului cu apă.
În cazul procesării spodumenului în procesul de sinterizare, efectuat la 920-1150 ° C, a-spodumenul este transformat în / 3-spodumen, care intră într-o reacție de schimb cu sulfat de potasiu:
2 (Li, Na) [Al (Si03) 2] + K2S04 2 (K, Na) [Al (Si03) 2] + U2S04. (U-2)
După răcire, a-leucite trece în β-leucite. Tranziția a * # 9632; / 3-spodumenul promovează dezvoltarea rapidă a reacției de fază dopată solid datorită faptului că atunci când rearanjăm atomii de zăbrele au crescut mobilitatea.
Deoarece reacția (10.2) este reversibilă, o cantitate mare de K2S04
În Fig. 80 prezintă o schemă tipică pentru prelucrarea spodumenului prin metoda sulfat.
Taxa este sinterizat în cuptoare rotative, la 1100 - 1150 ° C, timp de 1 -. 2 h Solubilizarea se realizează în frig în mori cu tambur (Li2S04 solubilitate scade cu temperatura roz sheniem).
Lichidele sulfatate conțin 110-150 g / l Li2S04, 150 -
200 g / l K2S04, cantități semnificative de impurități Na2S04
Amestecare și măcinare Cnenatfue
(Conversia în K2SO4 și pi în dump)
(pentru prepararea soluției de Na2C03j
Fig. 80. Schema tehnologică pentru prelucrarea spodumenului prin sinterizare cu sulfat de potasiu
Sulfați Mg, Al, Fe. Aceste impurități sunt precipitate sub formă de hidroxizi prin hidroxid de sodiu sau carbonat de potasiu. Prelucrarea ulterioară a soluțiilor eliberate cu carbonat de litiu se realizează utilizând o varietate de opțiuni. Unul dintre acestea este prezentat în Fig. 80. în acest exemplu de realizare, o cantitate mare de voal sul de potasiu este izolat prin cristalizare 3K2S04 sare dublă - Na2S04 (glaserite) utilizat pentru prepararea spodumene lot cu K2S04.
Metoda sulfatată este de asemenea utilizat pentru prelucrarea les pidolita tsinnvaldita și diferența numai într-un văl sul de dozare de potasiu în sarcina și mai mică decât temperatura de sinterizare (850 - - 950 ° C).
Avantajele metodei sulfate de prelucrare a materiilor prime de litiu includ versatilitatea și gradul înalt de disecție a concentratului. Dezavantajul este un consum ridicat de sulfat de potasiu. Cu toate acestea, crearea unor scheme mai raționale de prelucrare a soluțiilor care asigură un grad ridicat de regenerare a K2S04 va îmbunătăți semnificativ economia procesului.
Metoda de calcar constă în sinterizarea concentratelor de litiu (spodumene sau lepidolite) cu var sau cretă. Prin spălarea ulterioară a turtei cu apă se obține o soluție care conține hidroxid de litiu, care cristalizează ca rezultat al evaporării soluției în monohidratul LiOH-H20.
Luați în considerare elementele de bază ale acestui proces utilizând exemplul de spodumenă. La sinterizarea spodumenului cu var (sau creta) în cuptoare tip tambur la 1150 - 1200 ° C, se formează aluminat de litiu și silicat de calciu:
Li20 • A1203 • 4Si02 + 8CaO =
= Li20 • A1203 + 4 (2CaO • Si02). (10.3)
Când se spală turta cu apă în prezența unui exces de var, aluminatul de litiu reacționează cu Ca (OH) 2 pentru a forma hidroxid de litiu:
Li20 • АІ2Оетв) + Са (ОН) 2 (radioactivitate) = 2БІОН (раств) + СаО • А12Оэтв). (Yu.4)
Aluminatele de potasiu și sodiu conținute în sinter reacționează de asemenea cu Ca (OH) 2, formând KOH și NaOH. Hidroxidul de litiu LiOH • HjO este cristalizat din soluții prin evaporare sub vid. Evaporarea se efectuează în mai multe etape. Din soluții cu o concentrație de LiOH
160 g / l după răcire, se separă cristalele LiOH • H20, care sunt separate prin lichidul mamă prin centrifugare. Soluția mamă este returnată la evaporare. Ca acumulare de impurități, lichidele mamă sunt periodic eliminate din ciclu și trimise la regenerare.
Dacă este necesar, cristalele LiOH • H20 sunt purificate prin recristalizare, utilizând apă purificată pentru dizolvare. Pentru a obține hidroxid de litiu anhidru, monohidratul este deshidratat la 600-650 ° C.
Metoda de calcar este, de asemenea, utilizată în prelucrarea concentratelor lepidolitice. Spre deosebire de spodumeni, sinterizarea lepidolitului cu var (sau creta) se efectuează la o temperatură mai mică (900-950 ° C).
Avantajele metodei includ var aplicabilitatea acestuia la orice tip de litiu concentrate pentru prepararea directă de hidroxid de litiu, ieftinătate EeJ Gent, utilizarea deșeurilor (zguri conțin - care conține silicați și aluminați de calciu) pentru producerea de materiale de construcție tricotate-cimentoase, precum posibilitatea obținerii sărurilor de potasiu din lichidele mamă.
Cu toate acestea, metoda prezintă dezavantaje serioase. Este preferabil aplicabilă unei litiu concentrate bogate, cu toate acestea, în acest caz, extracția produsului finit nu depășește 70%, datorită rastvorimos limitate Tew hidroxid de litiu și capacitatea de noroaie după vyschela Chivanov-setabile. Un alt dezavantaj este nevoia de evaporare a volumelor mari de soluții.
Prepararea clorurii pure de litiu
0,1; Si02 0,05; POF 0,005. 336
Pentru a obține clorură de litiu de această puritate, este necesar de obicei pre-purificarea carbonatului de litiu din impurități. Purificarea se realizează prin recristalizare printr-un bicarbonat de litiu bine solubil (metoda Trist). În acest scop, o suspensie apoasă prin Li2C03 trecut C02, ceea ce duce la trecerea la soluția de litiu ca bikarbona-ta LiHC03.
Când soluția este fiartă, bicarbonatul este distrus, din râu. Asc este precipitat cu Li2C03 purificat.
Pentru a obține clorura de litiu, carbonatul umed este dizolvat în acid clorhidric 30%. Soluția a fost purificată prin ioni impuri SOJ „VaS12 plus. Apoi, pentru îndepărtarea altor impurități, soluția a fost neutralizat prin adăugare de LiOH înaintea alcali ness 0,01 N. Hidroxizi de fierbere alocate, carbo-Nata sau bazic impurități de sare de calciu, bariu, magneziu și fier.
Soluția purificată cu o concentrație de LiCl 350 - 360 g / l este alimentată la evaporare. Dificultățile de evaporare și de deshidratare ulterioară a clorurii se datorează capacității mari de coroziune a LiCl și a soluțiilor sale. Pentru evaporare se utilizează aparate din ceramică sau aliaje speciale, iar pentru deshidratarea clorurii se folosește un aparat ceramic. Ca rezultat al evaporării, clorura de LiCl • H20 cristalizează. Clorura este apoi deshidratată la 120-150 ° C.
3. TEHNOLOGIA PRODUCȚIEI LITUIEI
Producția de litiu prin electroliză
Datorită afinității mari pentru oxigen și halogeni, litiul este obținut fie prin electroliza mediilor topite sau prin reducerea termică metalică cu distilare litiu.
Electroliza se realizează într-un electrolit cu un raport de LiCI: KC1 = 1: 1 (în greutate), care este aproape de tektiki compoziția ev în Sistemul LiCl - KC1, care se topește la 361 ° C Aceasta permite electroliza la 400-460 ° C.
În Fig. 81 prezintă o diagramă schematică a unui electrolizer cu două spații catodice separate de spațiul anodic prin diafragme. Carcasa din oțel a căzii este căptușită cu grafit, materialul cel mai stabil în ceea ce privește clorura de litiu. Cu toate acestea, grafit
Rіs.81. Diagrama unei celule electrolitice pentru obținerea litiului metalic: 1 - căptușeală din grafit; 2 - diafragma din grila de fier; 3 - catozi din oțel; 4 - frunze lichide; 5 - pâlnie pentru încărcarea sărurilor; 6 - o gaură pentru scoaterea lichidului de litiu; 7 - diafragmă; 8 - anod de grafit; 9 - capac de baie din oțel; 10-cameră pentru încălzirea băii; 11 - arzător cu gaz
Tvuet cu formarea de carbură de litiu Li2C2, descompunând în electrolit cu eliberarea de carbon. Învelișul din grafit și anodurile din băile industriale funcționează timp de aproximativ trei luni. Pentru a obține mai mare puritate zlektolizery metalic litiu utilizat cu pereți răcite cu apă, care este format din săruri garnissazh solidificate protector-rotativ-electrolit prin reacția cu un perete metalic.
Pentru a topi electrolitul, se poate utiliza încălzire externă, apoi regimul termic este menținut de căldura eliberată atunci când curentul trece prin electrolit.
Plăcile sunt fabricate din oțel cu conținut scăzut de carbon, anodii sunt tije de grafit. Potențialul de descompunere al LiCl și KC1 în electrolitul compoziției eutectice la 400 ° C este de 3,78 și, respectiv, 3,89 V, ceea ce determină o eliberare parțială a potasiului la catod.
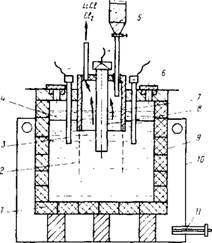
Electroliza este efectuată la 400-430 ° C, cu o densitate de curent la catod și anod de 2,0-5,0 și respectiv 0,8-1,5 A / cm2. Ieșirea curentă atinge 90-93%. Litiul lichid care iese pe catod plutește la suprafața electrolitului și este scos cu o lingură de plasă de fier în momentul în care se acumulează. Metalul este protejat de oxidare printr-un strat subțire de săruri care hidratează litiul lichid.
Clorul din spațiul anodic este trimis către absorber, irigat cu lapte de var.
Electroliza, în plus față de litiu, este posibil să se obțină aliaje de litiu cu alte metale (calciu, magneziu, metale grele). Pentru aceasta, fie introduceți clorura metalului corespunzător în electrolit, fie conduceți electroliza cu un anod solubil din metal, componenta de aliaj cu litiu.
Producția de litiu prin metode chimice în vid
Metoda electrolitică pentru obținerea litiului are anumite dezavantaje: clorura de litiu inițială este relativ scumpă. Datorită proximității litiului, litiului de potasiu și sodiu, litiul electrolitic conține o cantitate vizibilă de impurități de potasiu și sodiu, ceea ce necesită o purificare suplimentară. Este necesar să se absoarbă sau să se utilizeze clorul eliberat la anod. În acest sens, s-au dezvoltat variante ale metodelor vacuum-termice pentru obținerea litiului prin reducerea oxidului de litiu, monoaluminatului (Li20A1203) și, de asemenea, direct de la spodumenă.
Recuperarea oxidului de litiu. Oxidul de litiu se obține prin descompunerea termică a carbonatului de litiu. La 810, 890 și 1270 ° C, presiunea de CO2 deasupra carbonatului de litiu este de 2; 4,3 și respectiv 101 kPa (15, 32 și 760 mm Hg). Că în timpul descompunerii carbonatului de litiu nu a avut loc de topire (punct de topire Li2C03 735 ° C) sau, ceea ce ar dificilă îndepărtarea C02, oxid de litiu obținut proc-vaniem Li2C03 brichetate amestec și CaO (în cazul în care relația-SRI 1: 1,5 în greutate) la 850 ° C în vid (pentru a comuta reacția în partea de eliberare a C02). Ca rezultat, se obține un amestec de Li20 și CaO. Acesta din urmă, după cum se arată mai jos, este o componentă utilă a încărcăturii.
Ca un reducător accesibil de oxid de litiu, se adaugă siliciu pulverulent:
2Li20 + Si = Si02 + 4Li (10,5)
În condiții standard, reacția (10.5) este caracterizată de o schimbare pozitivă a energiei Gibbs și este enotermică:
DS »8K = 298 kJ, ДЯ ° 298К = 320 kJ.
În consecință, reacția (10.5) poate fi efectuată la temperaturi ridicate într-un vid cu distilarea litiului gazos din sfera de reacție. Cu toate acestea, în aceste condiții, o parte din octida de litiu este legată de ortosilicare:
4Li20 + Si = 4Li (ra3) + Li4SiQ4. (10.6)
Oxidul de calciu prezent în sarcina de pornire previne această reacție prin legarea de Si02 la orto-silicat de calciu:
Li4Si04 + Si + 4CaO = 4Li (ra3) + 2Ca2Si04; (YU.7)
Д ^ іооок = -351 КДж.
amestec calcinat de litiu și calciu sunt zdrobite, dizolvate, amestecarea cu pulbere de siliciu (10% exces calculat față de co-lichestva) și pelete din acest amestec a fost încălzit într-un cuptor cu vid la 1000-1300 ° C și o presiune de 0,113 Pa în cuptor. Litiul este colectat într-un condensator. Randamentul litiului la 1000 ° C este de 75%, la 1300 ° C - până la 93%. Principalele impurități: 0,04% Ca și 0,01% Si.
Recuperarea aluminatului de litiu. Litiu de mare puritate cu randament de 95 - 98% poate fi obținut prin reducerea mono-luminatului de litiu cu aluminiu în vid la 1150 - 1200 ° C. Aluminatul de litiu se obține prin calcinarea unui amestec de Li2C03 și A1203.
Recuperarea se efectuează în funcție de reacție:
3 (Li20 • A1203) + 2A1 = 6Li (ra3) + 4Al203. (Yu.8)
Presiunea de litiu de echilibru pentru această reacție la 1100 ° C este de 33,3 Pa. În consecință, reducerea poate fi efectuată la 1200 ° C și o presiune reziduală de aproximativ 13,3 Pa. Pentru a obține o recuperare ridicată a litiului, se utilizează un exces de aluminiu. Reducerea aluminatului de litiu nu necesită introducerea oxidului de calciu în sarcină, ceea ce asigură producerea unui metal de o puritate mai mare.
Oxidul de alumină rezultat este utilizat pentru a produce aluminat de litiu.
Pentru purificarea de impurități mecanice litiu este utilizat și topite prin sedimentare vaseline strat sau para ulei finlandezilor și filtrarea litiu lichid prin filtrele de sită sau sârmă de fier, titan sau molibden. Titanul și zirconiul, uraniul pulverizat sau spongios, pot servi drept absorbanți ai oxigenului și azotului din litiu topit. Aceste metale sunt practic insolubile în litiu.
Purificarea din alte metale alcaline se efectuează utilizând o diferență în stabilitatea termică a hidrurilor. Presiunea de disociere a hidrurilor LiH, KH și NaH atinge 0,1 MPa (1 at.) La 850, 427 și, respectiv, 420 ° C. Punctul de topire al hidrură de litiu este de 688 ° C. Atunci când litiul este încălzit în hidrogen la 700-800 ° C, potasiu și sodiu se evaporă și LiH rămâne, care este apoi descompus prin încălzire în vid. Litiul puternic contaminat, de exemplu, obținut prin recuperarea spodumenului, poate fi purificat prin rafinare electrolitică.
Metoda de rafinare a litiului prin distilare în vid este eficientă. Mai întâi, la 450 ° C, cantitatea principală de impurități ale metalelor alcaline (potasiu, sodiu) este distilată. Litiul este apoi evaporat la 600-800 ° C sub o presiune de 1,3 x 10-3 Pa
Măsuri de siguranță, ambalare și depozitare pe bază de litiu
Când topiți și turnați litiul în aer, acesta poate fi aprins. Un metal aprins recomandat umple clorura de sous-chimice de sodiu, clorură de litiu, sodă (nu Bikar-Bonate) sau un amestec constând dintr-o pulbere inertă (Gras-fit, clorură de sodiu), 10 - 20% din substanțe organice vâscoase (rășină amestecată cu polietilenă) și aditivi de stearați și talc. Litiul este produs sub formă de lingouri, granule, tije, sârmă. Litiu depozitat într-un recipient etanș sub un strat de masă păstoasă de fier din ceara și uleiul-mină eral sau benzină sau eter de petrol, umplerea recipientului de sus. Înainte de folosirea uleiului mineral de litiu se spală cu eter de petrol sau benzen, care este apoi evaporat sub vid. stoca convenabil litiu, se zapressovyvaya în coajă cu perete subțire sigilate tubular din cupru sau aluminiu, din care apoi piesele dorite pot fi tăiate cu litiu.
Articole similare
-
Utilaje, tehnologii, materiale și instalații de producție de spumă din beton
-
Tehnologia Premix, portalul principal al fermei - totul despre afacerea din agricultură
Trimiteți-le prietenilor: