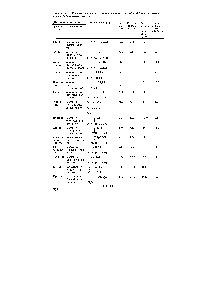
Tabelul 6.7. Caracteristicile fizico-chimice ale a-aminoacizilor care alcătuiesc proteinele fibrilare
Proteine și enzime. Proteine globulare și fibrilare. [C.264]
Principala diferență între lanțurile de proteine și polietilenă sau polietilen tereftalat (dacron) este că în molecula de proteine, nu toate grupurile laterale sunt aceleași. În proteinele fibrilare, o anumită secvență repetitivă de grupuri laterale conferă proprietăți mecanice specifice unei anumite proteine de cheratină sau colagen. Proteinele globulare au o structură și mai complexă. Aceste molecule conțin de obicei de la 100 la 500 de aminoacizi g, polimerizați într-un lanț lung. și secvența completă a resturilor de aminoacizi din fiecare moleculă a aceleiași proteine globulare este aceeași. Aceste reziduuri pot fi hidrocarbonice, acide, bazice, neutre sau polare. Convoluția lanțului proteic într-o moleculă globulară compactă [c.313]
Proteinele sunt polimeri ai aminoacizilor. Proteinele fibrilare sunt principalul material structural al părului, pielii, unghiilor, mușchilor și tendoanelor. În aceste structuri, lanțurile de proteine sunt înfășurate cu catene în lanțuri catenare sau legate între ele prin legături de hidrogen în foi. Proteinele globulare includ enzime, molecule purtătoare și anticorpi. În proteinele de acest tip, lanțurile pot avea formă de spirale sau foi. dar apoi aceste structuri se îndoaie în mod repetat, pliate în molecule compacte izolate. [C.338]
La începutul anilor '50 chimistului american Linus Pauling (b. 1901) a sugerat că lanțul polipeptidic este pliat într-o spirală (ca o scară în spirală) și este menținut în această poziție prin legături de hidrogen. Această idee sa dovedit a fi deosebit de fructuoasă pentru proteinele fibrilare relativ simple, din care se compun acoperirea și țesuturile conjunctive. [C.130]
Forma lanțului proteic determină funcția proteinei din celulă sau organism. Unele proteine sunt înfășurate într-o minge (proteine globulare). Altele rămân dezvelite pentru ele, caracterizate prin interacțiunea grupurilor laterale ale lanțurilor vecine cu formarea structurilor liniare plane sau lineare (proteine fibrilare, Figura 11.8 [C.453]
Proteine fibrilare (skl proteiNi) Lanțuri polipeptidice. formând fibre sau spirale cea mai mare parte a acestora - aminoacizii simpli sunt în mare parte slab solubili în apă [c.211]
Sunt date metode pentru estimarea masei moleculare. polidispersie. forma și dimensiunea macromoleculelor, sinteza polimerilor formatori de fibre prin polimerizare și policondensare la rate de conversie scăzute și adânci este considerată. și oferă, de asemenea, informații de bază privind chimia și fizicochimia polimerilor naturali care formează fibre de celuloză, chitină și proteine fibrilare. Prezentarea se bazează pe exemple cantitative și probleme întâlnite cel mai adesea în practica științifică și tehnologică. [C.2]
Calculați coeficientul de difuzie al unei molecule sferice a unei proteine fibrilare cu o masă moleculară de 10 și [c.72]
Fibroina și sericina sunt proteine fibrilare care alcătuiesc baza polimerică a mătăsii naturale. [C.375]
Pentru unele proteine fibrilare [t], soluția este [c.120]
Al doilea este că formarea fibrelor este procesul de transferare a sistemului la o stare orientată în stare de echilibru ca urmare a aplicării câmpurilor de forță exterioare (mecanice, electromagnetice, enzimatice). Prin urmare, proteinele fibrilare (colagen fibroin) sunt cele mai eficiente ca polimeri care formează fibre. [C.336]
Această reacție, efectuată în soluție de Nal, poate fi utilizată pentru dizolvarea proteinelor fibrilare. [C.362]
Proteinele fibrilare, inclusiv părul, pielea, mușchii și unghiile, îndeplinesc funcțiile structurale. Proteine globulare. cum ar fi enzimele și hormonii, fac o activitate biochimică specifică. Comparați forma moleculelor și solubilitatea în apă a acestor două clase de proteine. De ce solubilitatea în apă pentru proteinele fibrilare este adesea atât de diferită de cea a proteinelor globulare în apă [p.457]
Aceste reacții sunt utilizate pe scară largă în tratamentele tehnologice ale proteinelor fibrilare [c.362]
Acțiunea de acilare pe proteinele fibrilare ale clorurilor acide are loc atât în OH-, cât și în NH2- [c.368]
O altă clasă mare de proteine formează proteine fibrilare. Ele exercită în organism în principal rolul de materiale structurale. Printre acestea se numără și keratina. Este o parte din piele, păr, lână, unghii și alte țesuturi excitat. Colagenul este un alt tip de proteine fibrilare. fibrele de mătase și țesuturile de insecte care se găsesc în tendoane, în stratul subcutanat și corneea ochilor până la fibrilare. Proteinele, carbohidrații și lipidele (grăsimi cu lanțuri lungi și acizi grași) joacă rolul de materiale de construcție în orice organism viu. [C.313]
Conform ideilor noi, proteinele sunt împărțite în două grupuri diferite - din punct de vedere morfologic - proteine globulare și fibrilare. Primele includ soluții cristaline, mai puțin sau mai puțin solubile în apă sau în soluții de sare, molecule ale căror molecule seamănă cu un uiap, un elipsoid de rotație. cilindru sau disc. Exemple de astfel de proteine sunt hemoglobina și mioglobina. Concluziile privind forma moleculelor lor se fac pe baza măsurătorilor viscometrice, cu raze X, osmometrice și microscopiei electronice. [C.396]
Interacțiunea proteinelor fibrilare cu acizii halogenați este slăbită în seria I> Br> Cl> F. [c.369]
Pentru modificarea reacțiilor fibrilare, se utilizează reacții de epoxidare (de exemplu cu epiclorhidrină), precum și tratarea cu brometilamină la pH> 7. [C.370]
Proteinele fibrilare sunt prezente în păr, mușchi, piele și picioare - [c.453]
A-helixul proteinei fibrilare (resturile de 3 aminoacizi-yx) este măsurat paralel cu axa sa. Lungimea sa este de 0,5 nm. Câte resturi de aminoacizi trebuie adăugate pe secundă la fiecare helix a fibrei de keratină, dacă părul uman crește cu 15,24 cm pe an [c.119]
În această situație, acest grup de substanțe proteice nu se dizolvă în solvenții utilizați pentru dizolvarea proteinelor fibrilare. O caracteristică a structurii primare a proteinelor. aparținând grupului de keratină. este un număr relativ mare de unități care conțin sulf (Met, ys, yS-Sy). [C.377]
Sub formă de molecule, toate proteinele sunt împărțite în două grupe mari de fibroase (sau fibrilare) și globulare. Primele sunt molecule filamentoase insolubile în apă. ale căror lanțuri polipeptidice nu au o formă globulară. și alungită de-a lungul unei axe. Cele mai multe proteine fibrilare au funcții structurale sau de protecție. [C.425]
Proteinele fibrilare sunt caracterizate printr-un aranjament regulat de grupuri polar de-a lungul unui lanț polimer rigid lung. Pentru una dintre cele mai caracteristice proteine fibrilare - colagen - există date din literatura cu privire la viteza de ultrasunete în soluție [202], din aceste date, o compresibilitate parțială adiabatică a fost calculată în [161]. a căror valoare este anormal de scăzută. Pe scala de compresibilitate (vezi Figura 3.12), este prezentat calculul aditiv al lantului de colagen complet expandat. Această valoare poate fi citită [c.60]
Se schimbă, de asemenea, situația surselor de materii prime pentru producerea de materiale polimerice. În ultimii 40-50 de ani, dezvoltarea producției și prelucrării materialelor polimerice formatoare de fibre bazate pe utilizarea de produse naturale adâncime de prelucrare a materiilor prime de hidrocarburi. Cu toate acestea, având în vedere epuizarea rapidă progresivă a rezervelor de petrol și gaze din lume tot mai mare atenție acordată problemelor tehnice de re-utilizarea polimerilor naturali - diferite polycarbo- și proteine fibroase, care contribuie la succesul ingineriei genetice și în alte domenii ale biotehnologiei. [C.8]
Complexul de proprietăți fizice și chimice ale polimerilor naturali care formează fibre este condiționat de nivelurile primare, secundare și superioare ale organizării lor structurale. Fiecare dintre polimerii de interes ca formator de fibre (celuloză, proteine fibrilare chitinoase) are un anumit scop biofuncțional. Particularitatea proceselor biosintetice este aceea că structura primară a macromoleculelor acestor polimeri se formează ca regulat, în ciuda posibilității de includere accidentală a legăturilor "defecte" în ele. Regularitatea structurii lanțurilor de polimeri predetermină posibilitatea autoreglementării lor (cristalizarea). Parametrul de flexibilitate al macromoleculelor din polimerii de formare a fibrelor naturale este ceva mai mare decât 0,63, ceea ce le permite să fie clasificați ca polimeri cu lanț semi-rigid. [C.288]
Întrebarea. Mătase naturală este produsă în principal prin tratamente fizico-chimice ale gogoșilor de viermi de mătase Bombyx mon. Coconi deformabile această larve de insecte, sunt coajă compozite naturale construite din fibre fibroină durabile (tije) conectate printr-o altă proteină linie - (. Vezi Tabelul 6.8) Sericin. Pentru protecția împotriva bacteriilor patogene, furnizarea de gaz și de schimb de apă cu firele din jur de suprafață medie din care este construit coconul. acoperite cu un strat subțire lipidic proteic-lipidic. Fileul de cocon este de 97-98% compus din proteine fibrilare foarte orientate [c.342]
Un număr mare de combinații reciproce de unități de aminoacizi în lanțul polipeptidic. determinând structura primară a proteinei. determină posibilitatea existenței unei varietăți foarte mari de proteine și a specificității funcțiilor lor. Cu toate acestea, structura primară a proteinei. care posedă proprietăți funcționale specifice (de exemplu, proteine fibrilare), este reprodusă destul de precis în procesul de biosinteză, care determină posibilitatea activității vitale a organismelor. A fost deja remarcat mai devreme că tranzițiile conformaționale în lanțul polipeptidic pot fi realizate în principal ca urmare a rotirii în jurul grupului CH2 Gly, care joacă rolul unei balamale. [C.344]
Ordonarea reciprocă a lanțurilor polipeptidice (cristalizare) are loc nu numai cel puțin a reduce conținutul de apă în sistem (atunci când se usucă substratul proteic), dar, de asemenea, prin încălzire într-o atmosferă inertă. Viteza maximă a procesului de cristalizare se realizează pentru ambele componente proteice din mătase naturală - fibroin și sericin - în regiunea 180-200 ° C sericin amorfa este ușor solubil în apă la 20 ° C la pH 7,0 (0,1), în timp ce forma sa cristalină este practic insolubil. Temperaturile de tranziție vitroasă Tc fibroină și Sericin sunt similare și în domeniul 173-175 ° C și, respectiv, 169-172 ° C. Atât proteina fibroasa care constituie 97-98% în greutate fir cocon, haraeterizuyutsya afinitate aproximativ egală pentru apă de hidratare fibroin căldură și sericin sunt, respectiv, 50.9 și 52.1 kJ / mol. [C.376]
Structura lui a-glargal este cel mai important și mai răspândit caz de organizare a moleculelor globulare de proteine (de exemplu, enzime). Structura stratului p-pliat se găsește în proteine fibrilare, cum ar fi mătase fibro-nică și p-keratină (piele, păr, unghii, coarne etc.). [C.271]
Și mătase fibroină și forma p formei k aparțin grupului de proteine fibrilare, în care aproape complet desfășurați lanțurile polipeptidice sunt organizate într-o structură pliată. [C.271]
Fibrilară sau proteine fibroase (din latină cu gov gSha - fibră) constau din macromolecule sub formă de fire alungite subțiri, de obicei interconectate. Acest grup include proteine care sunt componente ale pielii și tendoanele (colagen. Gelatina), păr și corn (keratina), mușchi (miozina), si altele. In organism, ele funcționează în principal funcția de mecanic, cu toate că unele proteine fibrilare posedă activitate biologică . Deci, numit mai sus miozip este acidul o enzimă clivează adenazintrifosfornuyu (ATP), care are o cantitate mare de energie. lansat de decolteul ei. [C.338]
Proteinele fibrilare la temperatura camerei sunt de obicei insolubile în apă, dar sunt capabile să se umfle în ea. care indică proprietățile lor hidrofile. [C.338]
Proteinele fibrilare constau din lanțuri de polipeptide, interconectate în principal de întregul lor, pentru a forma structuri spirulare complexe numite structura secundară a proteinei (Figura 39). [C.360]
Articole similare
Trimiteți-le prietenilor: