Luați trei tuburi și turnați 2-3 ml de soluție în fiecare: sulfat de cupru (II) în prima, clorură de potasiu în al doilea și sulfat de aluminiu în al treilea. Apoi, adăugați la fiecare tub: un pic de soluție de hidroxid de sodiu, al doilea - o soluție de fosfat de sodiu, iar în al treilea rând - o soluție de clorură de bariu. Ce cauți?
Faceți ecuații moleculare și ionice ale reacțiilor. Faceți o concluzie.
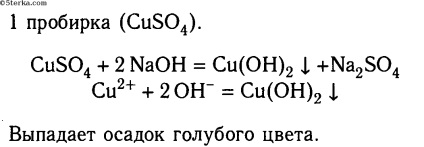

Concluzie: dacă se produce precipitarea, reacțiile ajung până la sfârșit.
În două eprubete, se toarnă 2-3 ml de sulfit de sodiu și respectiv de carbonat de sodiu. Apoi, se toarnă în fiecare dintre ele o soluție de acid azotic. Ce cauți?
Faceți ecuații moleculare și ionice ale reacțiilor. Faceți o concluzie.
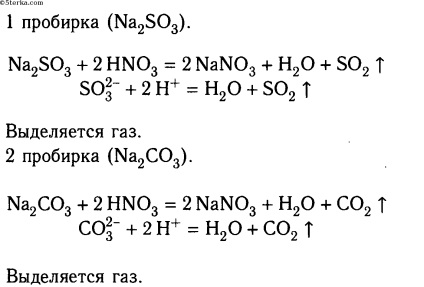
Concluzia 1: În cazul în care gazul este eliberat, reacțiile ajung până la capăt.
Concluzia 2: carbonul și dioxidul de sulf sunt instabile.
Într-un singur tub, se toarnă 3-4 ml de soluție de hidroxid de sodiu și se adaugă două sau trei picături de fenolftaleină. Soluția devine purpurie. Apoi se adaugă acid clorhidric sau soluție de acid sulfuric până la decolorare.
Într-un alt tub, se toarnă aproximativ 2-3 ml de sulfat de cupru (II) și se adaugă puțină soluție de hidroxid de sodiu. Se formează un precipitat albastru de hidroxid de cupru (II). Se toarnă acidul sulfuric în tub până când sedimentul se dizolvă. Formați ecuațiile pentru reacțiile care apar în forma moleculară și ionică. Explicați de ce în prima eprubetă a fost o decolorare, iar în cea de-a doua - dizolvarea sedimentului. Care este proprietatea comună a bazelor solubile și insolubile?

Precipitatul hidroxidului de cupru este dizolvat deoarece sulfatul de cupru este un compus solubil.
Bazele solubile și insolubile în apă pot fi dizolvate în soluții acide. Se produce o reacție de neutralizare.
Articole similare
-
Lucrări de cercetare pentru clasa a II-a "cum se nasc desene animate"
-
Lucrările creative ale studenților mei povestesc despre culori, rețeaua socială a educatorilor
Trimiteți-le prietenilor: