Raport privind activitatea de laborator 1
Student gr. O-24
Calcul chimic quantum nonempiric al moleculei CH4.
1. OBIECTIVE ȘI SARCINI DE CALCUL.
Scopul calculului: Determinarea criteriilor de selecție și studiul principiilor de construire a unui set de bază standard pentru calculul sistemelor moleculare. Studiul metodelor de interpretare a rezultatelor calculului și reprezentării unei molecule sub forma unui vector al proprietăților pe baza acestora. Introducere în pachetul software GAMESS.
Sarcina de calcul: Selectați cea mai mică posibilă bază optimă pentru ab initio calcule lungimile legăturilor și unghiurile de legătură ale moleculelor de CH4 cu sistem software GAMESS cu o precizie de 0,01 A pentru lungimile legăturilor și 1 ° pentru unghiurile legăturilor, comparabile cu experimentale. Pe baza rezultatelor de calcul, evaluați stabilitatea și factorii care determină reactivitatea acestei molecule.
2. CARACTERISTICI ȘI JUSTIFICAREA METODEI DE CALCUL.
Calculul moleculei CH4 a fost efectuat în conformitate cu complexul de program GAMESS din setul de bază standard 6-31G * Poplot. Această bază este divizată de valență. Valorile MO sunt reprezentate de combinații liniare de 2 combinații comprimate de orbite gaussiene, miezul MO - primul. La fiecare atom non-hidrogen, 6 componente ale funcțiilor d ale polarizării sunt, de asemenea, centrate. Astfel, baza pentru calculul moleculei CH4 constă din 23 de funcții:
1 * C (1 (1s) + 2 * 4 (2s + 2p) + 6 (3d)) +
4 * H (2 (1s) = 23
Toate valență două funcții de bază exponențială (6-31 G *), care acoperă în MO 1s - single-exponențială. S- și p-compresiune corespunzătoare (din punct de vedere formal), un principal număr cuantic n, sunt îndoite în sp-shell [(2s + 2p), (3s + 3p)] și sunt prezentate pentru diferite combinații liniare ale primitivilor cu aceleasi multiplicatorii eksponetsialnymi Gaussian.
Fiecare exponent al compresiei compresiei este reprezentat de o combinație liniară de 6 primitivi gaussieni (6 -31G *). Fiecare exponent al compresiei pentru electronii de valență este reprezentat de o combinație liniară de primitivi gaussieni de 3 (6-3 1G *) sau 1 (6-31 G *).
Baza 6-31G * este cea mai mică bază posibilă pentru calcularea lungimilor de legătură și a unghiurilor de valență ale moleculei CH4 cu precizie experimentală. Adăugarea funcțiilor d de polarizare (6-31G *) ia în considerare polarizarea carcaselor electronice "în vrac" ale atomilor de halogen în formarea legăturilor (oferă o reducere a lungimii legăturilor
3. INTERPRETAREA REZULTATELOR CALCULULUI.
1. Evaluarea stabilității unei molecule.
Entalpia formării moleculei CH4 din substanțe simple este:
f H 0 (CH4) = E (CH4) - 1 / 2E (C2) - 2E (H2) = -40.19517 + ½ * 2 * + 75.37903 1.12683 -0.25184 au = = -158,032 kcal / mol -661,205 kJ / mol
Concluzie: molecula CH4 este stabilă în condiții standard.
2. Proprietățile legăturilor moleculei CH4
Geometria rafinată și ordinele de legătură ale moleculei CH4:
4. Determinarea proprietăților nucleofile și electrofile ale moleculei CH4.
Energia moleculei LMWO a CH4 este pozitivă (0,2571 UA).
Concluzie. Molecule nucleofile CH4.
5. Determinarea durității și moliciunii moleculei.
HOMO al moleculei CH4 este degenerat de trei ori. Diferența dintre energia și energia MO este mai mică (0.3984 AU).
Concluzie. Molecula CH4 este un reactiv rigid.
Rigiditatea moleculei CH4:
=
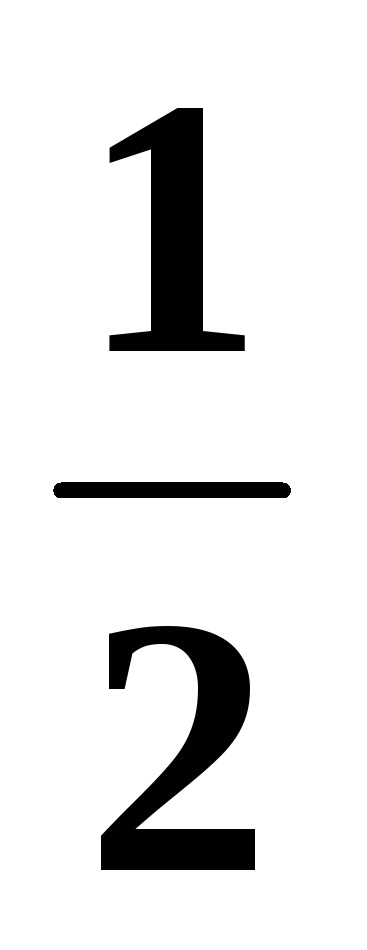
Miezime a moleculei CH4:
6. Determinarea poziției centrelor de reacție.
Reactivitatea unei molecule CH4 ca reactiv rigid este determinată de sarcini pe atomi. Distribuția sarcinilor pe atomi de către Mulliken este după cum urmează:
Încărcarea negativă maximă pe atomul C.
Concluzie. Atomii C sunt centrele cel mai probabil de atac electrofil.
7. Evaluarea solubilității.
Momentul dipolului electric al moleculei CH4 are o valoare mică de 0,00 D.
Concluzie: molecula CH4 este solubilă în principal în solvenți nepolari.
Articole similare
-
Măsoară lungimea moleculei în mod clar că nu putem măsura direct atât de mică
-
Măsurarea lungimii moleculei dnk - cartea de referință pentru chimie 21
Trimiteți-le prietenilor: