soluţii
Dacă se adaugă zahăr în apă, se va dizolva și se va obține o soluție de zahăr în apă. Dacă nu există particule de zahăr în soluție, o astfel de soluție va fi omogenă (omogenă). În această soluție, zahărul acționează ca o substanță dizolvată, apa - un solvent. Dacă zahărul este adăugat la soluție în porții mici, acesta se va dizolva numai până la o anumită limită, atunci când cristalele de zahăr adăugate la soluție nu cad imediat în fundul vasului, chiar și cu amestecare profundă. O soluție în care toată cantitatea posibilă de substanță solubilă s-a dizolvat la o anumită temperatură se numește saturație. Cantitatea de substanță dizolvată se numește solubilitate.
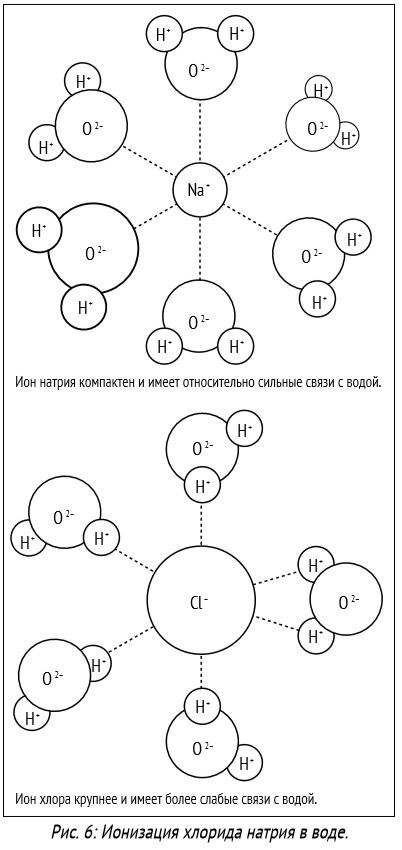
1. Temperatura. Cu temperatură în creștere, solubilitatea majorității substanțelor solide și a lichidelor crește. Solubilitatea gazelor cu temperatură în creștere este de obicei redusă.
2. pH. pH-ul este o măsură a acidității sau alcalinității relative a unei soluții (o descriere detaliată va fi dată mai jos). Solubilitatea multor substanțe chimice depinde de nivelul pH-ului. Unii compuși, de exemplu sărurile polivalente de hidroxid și carbonat, devin mai solubili în mediul acid. Unii compuși se dizolvă numai într-un mediu cu un pH neutru, alții (acizi organici, cum ar fi lignitul și lignosulfonatul) se dizolvă mai bine atunci când pH-ul crește până la> 9,5. Ionii de calciu și magneziu se dizolvă la niveluri de pH de la acid la neutru, dar devin mai puțin solubili la niveluri ridicate de pH (vezi exemplul cu calciu din Figura 7).
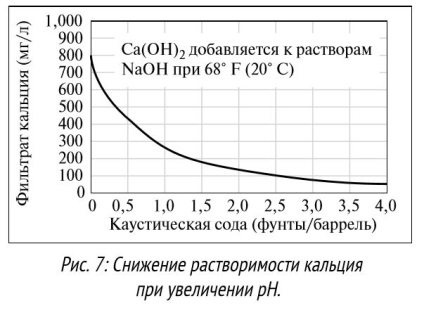
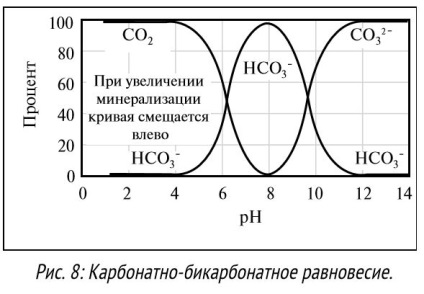
Odată cu creșterea de creștere număr gidroksidionov ca pH, ioni reacționează cu calciu și magneziu, formând un precipitat de hidroxid de calciu și magneziu. Unii compuși, de exemplu, ioni de carbonat sau sulfură, își schimbă starea cu un pH în creștere. De exemplu, gazul CO2 reacționează cu apă pentru a forma dioxid de carbon la un nivel scăzut al pH-ului. La pH neutru, CO2 reacționează cu hidroxid pentru a forma ioni bicarbonat, la ioni de carbonat de pH ridicat (vezi Figura 8). Solubilitatea multor componente ale fluidelor de foraj depinde direct de pH-ul soluției. De exemplu, la pH> 9,5, nu numai lignit mai solubile și lignosulfonatul, dar, de asemenea, aditivi cum ar fi guma de xantan, sunt mai eficiente la niveluri de pH de la 7 la 11. Unii aditivi sunt deosebit de sensibile la niveluri ridicate de pH. La un pH ridicat (> 10,5), adăugarea de poliacrilamidă este hidrolizată, eficiența acesteia fiind redusă. Majoritatea aditivilor sunt proiectați pentru a fi utilizați într-un anumit interval de pH. Pentru o mai bună dizolvare a ingredientelor, anti-coroziune a echipamentului de scurgere și manipularea în condiții de siguranță a substanțelor chimice. fluide de foraj reactivi de pH, pe bază de apă menținută în mod normal, la un nivel de la 8 la 12. Inginerii de noroi de foraj trebuie să cunoască nivelurile acceptabile ale pH-ului și a menține pH-ul soluției într-un interval acceptabil.
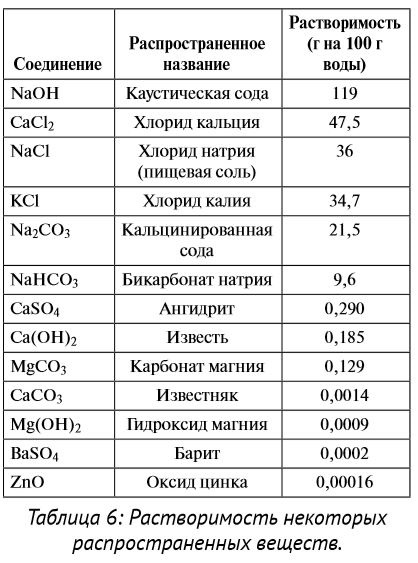
4. Presiune. Cu o presiune tot mai mare, o creștere a solubilității gazelor în lichide, dar presiunea nu afectează solubilitatea solidelor și lichidelor. Solubilitate crescută a gazelor este cel mai important din punct de vedere al condițiilor chimice din puț atunci când rezervorul de gaz sub presiune se dizolvă în fluidul de foraj. Cunoașterea solubilității relative este necesară deoarece cel mai puțin solubil reactiv precipită mai întâi. De exemplu, atunci când clorura de calciu este amestecată (aceasta este o substanță foarte solubilă) cu apă, clorura de calciu se descompune în ioni de calciu și clor. Dacă aceeași soluție adăugarea carbonatului de sodiu (o substanță cu o solubilitate medie), se împarte în ioni și carbonat de sodiu și carbonat de calciu (substanță cu solubilitate scăzută) intră imediat din soluție la o reacție sunt carbonat de calciu bine solubile și ușor solubil. Solubilitatea relativă poate fi utilizată pentru selectarea reactivilor pentru a elimina compușii inutili din soluție. Solubilitatea este afectată de ioni de diferite elemente și compuși conținute în solvent.
Articole similare
Trimiteți-le prietenilor: