§ 1. Cunoașterea teoretică a efectului termic. Concepte de bază ale termodinamicii. Efectul termic al reacțiilor chimice. Legile termochemiei ........................................ .......... ....... ......................... .... ... .str. 4
2. Determinarea experimentală a efectului termic. 10
§ 3. Aplicarea efectului termic în practică. "Încălzitoare" chimice și pungi de răcire. Acoperiri rezistente la căldură. Metoda termochimică de prelucrare cu diamant .................................................................................................... p.
După cum știți, viața de pe Pământ este imposibilă fără fluxul reacțiilor chimice. Ele formează baza pentru crearea și existența celor mai moderne obiecte. Fără reacții chimice, planeta noastră nu ar fi protejată de stratul de ozon, în adâncurile pământului nu ar ascunde mineralele. Prin urmare, reacțiile chimice sunt unul dintre cele mai importante lucruri de pe Pământ, iar studiul lor este un proces complex, dar foarte util.
Dar este imposibil să acoperi întreaga esență a reacțiilor chimice într-un singur abstract. Puteți descrie doar o parte a lor. De aceea am ales tema cercetării mele, probabil unul dintre cele mai interesante și, cu siguranță, unul dintre cele mai importante aspecte ale reacțiilor chimice - efectul termic.
Efectele termice ale reacțiilor chimice sunt necesare pentru numeroase calcule tehnice. Ei găsesc o aplicare extinsă în multe industrii, precum și în dezvoltarea militară. Cunoașterea efectului de căldură este, de asemenea, importantă pentru rezolvarea multor probleme practice. Prin reacții chimice cu căldura gazului arde în apartamentele noastre, nu există apă caldă, exista curent electric, din cauza acestui tip de reacții chimice conduc mașinile noastre, zbura avioane și rachete. Toate reacțiile de ardere sunt reacții termice. Gun, arme de foc, sudare și tăiere metale, lasere industriale ... Reacții chimice de pretutindeni.
Cu alte cuvinte, reacțiile chimice cu efect termic au intrat în viața modernă a omului și a societății. Tocmai pentru că acum ele fac parte integrantă din viața noastră și ar trebui să acordăm o atenție deosebită acestui subiect. De aceea acest subiect a fost ales de noi pentru scrierea unui eseu.
Scopul cercetării este diversificarea fenomenului efectului termic și posibilitatea aplicării acestuia în practică. Acest obiectiv poate fi atins prin rezolvarea mai multor sarcini pe care le-am stabilit:
1. Să se familiarizeze cu conceptul de termodinamică și principalele sale aspecte;
2. Să studieze secțiunea de termodinamică, numită termochimie;
3. Înțelegeți ce este efectul de căldură și ce semnificație are în chimie;
4. Aflați despre modalități diferite de a aplica cunoștințele dobândite în viață.
§ 1. Cunoașterea teoretică a efectului termic.
Concepte de bază ale termodinamicii.
Termodinamică (greacă. # 952; # 941; # 961; # 956; # 951; - "căldură" # 948; # 973; # 957; # 945; # 956; # 953; # 962; - "forța") - secțiunea de fizică aplicată sau inginerie termică teoretică, în care este investigată transformarea mișcării în căldură și invers. În termodinamică, considerat nu numai probleme de propagare a căldurii, dar schimbarea fizică și chimică asociată cu agent de absorbție a căldurii, și, invers, generarea de căldură în timpul transformărilor fizice și chimice. [1]
Din punct de vedere istoric, termodinamica a apărut ca o știință empirică (experimentală) despre modalitățile de bază de transformare a energiei interne a corpurilor pentru a efectua munca mecanică. Cu toate acestea, în termodinamica procesului său de dezvoltare a penetrat toate ramurile fizicii, acolo unde este posibil să se introducă conceptul de „temperatură“, și a permis să prezică, teoretic, multe fenomene cu mult înainte de teoria riguroasă a acestor fenomene.
Temporizarea chimică studiază transformările reciproce ale căldurii și energiei în sistemele chimice și descrie starea echilibrului chimic. Aceasta permite judecătorului în ce condiții este posibilă o reacție particulară [2].
În acest capitol vom cunoaște legile și conceptele fundamentale ale termodinamicii.
Transformările termodinamice respectă legile fundamentale ale termodinamicii - principii termodinamice. Există 3 în toate, plus o notă, numită și începutul punctului zero al termodinamicii.
Prima lege a termodinamicii este legea conservării energiei pentru procesele termodinamice. Citește:
Energia nu provine din nimic și nu dispare fără urmă, ci doar trece de la o formă la alta.
Energia este diferită. În cursul fizicii, ia în considerare tipurile sale, cum ar fi, de exemplu, potențial și cinetic. În chimie, energia internă a substanțelor (energia mișcării moleculelor și a atomilor lor) este mai importantă. Schimbarea energiei interne a substanțelor în cursul reacțiilor chimice este mult mai mare decât schimbarea potențialului lor și a energiei cinetice. Prin urmare, în desfășurarea experimentelor de laborator, nu aruncăm tuburi cu substanțe pentru a-și schimba energia (ceea ce trebuie să realizăm reacția), dar folosim și alte metode. O parte din energia internă asociată cu mișcarea electronilor din atomi se numește energie chimică.
În plus, în reacțiile chimice este important să se cunoască energia termică a substanțelor. Acesta este numele energiei totale a atomilor dintr-o moleculă și molecule ca întreg. Măsurarea energiei termice este temperatura corpului. În plus, depinde de starea agregată a substanței și de tipul de molecule. Energia termică este eliberată, de exemplu, atunci când energia chimică a materiilor prime în timpul reacției chimice este mai mare decât energia produselor.
Legea conservării energiei pentru reacțiile chimice spune:
Energia termică eliberată în timpul unei reacții chimice este egală cu schimbarea energiei chimice.
A doua lege a termodinamicii are mai multe formulări diferite, dar în același timp echivalente.
1 - Postulatul lui Clausius [3]. Un proces în care nu există alte modificări, cu excepția transferului de căldură de la cald la corpul rece este ireversibilă, care este, de căldură nu poate merge de la rece la un corp fierbinte fără alte modificări ale sistemului. Acest fenomen se numește disipare sau disipare a energiei.
2 - Postulatul lui Kelvin [4]. Un proces în care o operațiune de căldură continuă fără alte modificări în sistem, este ireversibil, adică este imposibil să se transforme lucrarea toată căldura luată de la sursa, cu o temperatură uniformă, fără a face alte modificări ale sistemului.
Reacțiile chimice cu efect termic sunt așa-numitele procese spontane, adică pe cont propriu. Astfel de procese includ atât reacții exoterme cât și endoterme.
Cu toate acestea, după efectuarea unui număr de experimente, sa stabilit că există factori care determină direcția reacțiilor spontane.
În reacțiile exotermice, căldura în evoluție încălzește reactivii, prelungind astfel timpul de reacție, pe lângă faptul că știm că în reacțiile exoterme energia scade. Astfel, reacțiile chimice merg spontan în direcția scăderii energiei substanțelor.
Dar multe reacții de descompunere (endotermie de tip) pot de asemenea să apară spontan, ceea ce înseamnă că scăderea energiei nu este singurul factor.
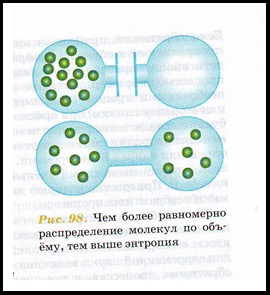
[5]
Entropia (din limba greacă. # 958; # 957; # 943; # 945; - turn, transformare) - în științele naturii - o măsură a tulburării unui sistem alcătuit din mai multe elemente.
Entropia este notată de S.
Rudolph Clausius a introdus pentru prima dată acest cuvânt în termodinamică în 1865. În termodinamică, înseamnă o măsură a disipării energiei ireversibile, o măsură a deviației procesului real de la ideal.
Cu cât este mai uniformă distribuția tuturor proprietăților sistemului (energie, presiune, temperatură etc.), cu atât este mai mare entropia. În direcția creșterii entropiei, apar toate procesele spontane.
Prin urmare, a doua lege a termodinamicii în ansamblu este formulată după cum urmează:
În sistemele izolate, procesele spontane pot să apară numai cu entropia în creștere. În procesele reversibile, entropia nu se schimbă.
A treia lege a termodinamicii: teorema lui Nernst: entropia oricărui sistem la zero absolută a temperaturii poate fi considerată întotdeauna zero.
Există, de asemenea, o notă la început. sau legea zero a termodinamicii.
Principiul punctului zero al termodinamicii citește:
Pentru fiecare sistem termodinamic izolat există o stare de echilibru termodinamic, care ajunge spontan în timp în condiții externe fixe.
La calcularea reacțiilor chimice, este important ca chimistii să cunoască aceste legi.
Termodinamica conține multe formule care descriu transformările energetice în cursul reacțiilor chimice și toți se supun legilor de bază discutate în acest capitol.
Efect termic.
Nici o reacție chimică nu trece fără costuri sau cu alocarea unei anumite cantități de energie sau căldură. Acest lucru se datorează faptului că în fiecare substanță există inițial o anumită cantitate de energie. Și în diferite substanțe această cantitate este diferită.
În timpul reacției, legăturile se rup în materiile prime și formează noi legături în produsele de reacție. Deoarece formarea unei legături are loc cu eliberarea și discontinuitatea ei - cu absorbția energiei, atunci reacțiile chimice sunt însoțite de efecte energetice.
Pe baza diferenței dintre rezerva de energie din materiile prime și produsele de reacție, se disting două tipuri de reacții.
Primul tip este reacțiile cu eliberarea căldurii sau cu reacțiile exoterme (din exo-out-ul grec). Aceasta include reacții în care rezerva energetică a materiilor prime este mai mare decât rezerva de energie a produselor de reacție. În acest caz, energia este eliberată în mediul înconjurător, deci este necesar să se organizeze eliminarea căldurii pentru a evita supraîncălzirea sau explozia reactorului chimic.
Reacțiile în care produsele au o cantitate mai mare de energie decât substanțele originale se referă la cel de-al doilea tip - reacții cu absorbție de căldură sau endoterme (de la endo-in greacă). În reacțiile endotermice, căldura necesară este absorbită din mediul înconjurător, astfel încât în laboratoare asemenea reacții să apară când sunt încălzite.
Pentru prima dată, termenii "exotermi" și "endotermici" au fost introduși de chimistul francez Pierre Berthelot [6]. considerat unul dintre fondatorii termochimiei [7].
Exemple de reacții exoterme sunt reacțiile de combustie. De exemplu, gazele naturale (metan CH4) ard în oxigenul aerului cu eliberarea unei cantități mari de căldură:
De asemenea, dizolvarea metalelor în acizi, reacțiile de neutralizare și multe altele sunt exoterme.
Un exemplu de reacție endotermă este formarea de monoxid de carbon (II) CO și hidrogen H2 din cărbune și apă, care are loc numai atunci când este încălzit:
Astfel, orice reacție chimică este însoțită de eliberarea sau absorbția energiei. Cel mai adesea, energia eliberată sau absorbită sub formă de căldură (cel puțin - sub formă de energie luminoasă sau mecanică). Această căldură poate fi măsurată. Rezultatul măsurătorilor este exprimat în kj (kJ) la 1 mol de reactant sau (mai puțin probabil) la 1 mol din produsul de reacție. Această cantitate se numește efectul termic al reacției.
Efectul termic este cantitatea de căldură eliberată sau absorbită de un sistem chimic atunci când apare o reacție chimică în ea.
Efectul termic este marcat de simbolul Q. Valoarea lui corespunde diferenței dintre energiile stadiilor inițiale și finale ale reacției.
În reacțiile exoterme, Q> 0.
În reacțiile endotermice Q <0.
Noi numim acest fenomen un efect de căldură. deși ar fi mai corect să vorbim despre efectul energetic al reacției.
Ecuațiile care ilustrează cursul reacțiilor chimice cu efect termic sunt numite termochimice. În aceste ecuații este important să se țină cont de stările agregate ale substanțelor care participă la reacție și de valoarea efectului termic în kJ.
Desemnarea stării agregate a materiei este de mare importanță. De exemplu, într-o reacție de combustie de hidrogen, apa se formează inițial sub formă de vapori (stare gazoasă) la care condensarea poate sta încă ceva energie. În consecință, pentru formarea apei ca lichid căldura măsurată de reacție este oarecum mai mare decât pentru formarea de numai abur, deoarece căldura de condensare a vaporilor aloca o altă porțiune.
Se utilizează de asemenea un caz special al efectului termic al reacției, căldura de ardere. Din numele în sine se vede că căldura de ardere servește pentru a caracteriza substanța utilizată drept combustibil. Căldura de ardere este atribuită unui mol de substanță fiind un combustibil (un agent reducător în reacția de oxidare), de exemplu:
unde 1300 kJ este căldura de ardere a acetilenei.
Dacă reacția este reversibilă și poate curge în direcții opuse, căldura înainte și înapoi reacțiile sunt egale în mărime și semn opus.
Energia stocată în molecule (E) poate fi amânată pe scara energetică. În acest caz, efectul termic al reacției (# 916; E) poate fi arătat grafic.
Articole similare
-
Șaibe pentru reglarea golurilor termice ale supapelor - vizualizarea subiectului
-
Prezentare pe tema Departamentului de Chirurgie Maxilofacială kgmu prelegere 1 subiect și conținut
Trimiteți-le prietenilor: