a). Formulați legea lui Kirchhoff pentru radiația termică. Care este sensul fizic al funcției universale Kirchhoff?
Raportul dintre abilitățile emise și absorbția nu depinde de natura corpului, este pentru toate organismele aceeași funcție (universală) a lungimii de undă și a temperaturii.
Legea lui Kirchhoff: unde - emissivitatea corpului, - capacitatea de absorbție, - funcția universală a lui Kirchhoff și T - temperatura corpului.
Cantitățile u, luate separat, pot varia extrem de puternic în timpul tranziției de la un organism la altul. Raportul lor este același pentru toate corpurile. Aceasta înseamnă că un corp care absoarbe mai puternic razele va emite mai puternic aceste raze.
Funcția universală Kirchhoff are o semnificație fizică: - funcția universală Kirchhoff nu este altceva decât emisivitatea unui corp absolut negru.
b). Atunci când o lumină cu o gamă largă de lungimi de undă trece prin hidrogen gazos la temperatura camerei, se observă numai liniile de absorbție ale seriei Lyman. De ce nu există linii de absorbție a altor serii?
Seria de absorbție Lyman corespunde tranzițiilor electronilor din atomul de hidrogen din starea solului. Atomul este în principal și nu în stare excitat. Într-adevăr, pentru trecerea unui atom într-o stare excitată, este necesar să informăm atomul energiei. O astfel de energie este transferată la atomi atunci când acestea se ciocnesc una cu cealaltă. La temperatura camerei, energia cinetică medie a atomilor de gaze. Această energie este complet inadecvată pentru a transfera un atom într-o stare excitat. Aceasta necesită o energie de ordinul mai multor eV.
c). Care este esența modelului nuclear al atomului propus de Rutherford? Pe baza rezultatelor experimentelor pe care le-a propus Rutherforde? De ce sa dovedit că modelul nuclear al atomului nu poate fi înșelat?
Un rol important în crearea modelului clasic al atomului a fost jucat de experimentele lui Rutherford cu privire la împrăștierea particulelor. El a investigat împrăștierea particulelor pe foliile Me.
Modelul nuclear al atomului Rutherford. Conform acestui atom de model constă dintr-un nucleu pozitiv cu sarcină Ze (Z - numărul ordinal al unui element din tabelul periodic, e - taxa elementară), cantitatea de 10 ~ 5 până la 10 -4 A (1A = 10 -10 m) și o masă de greutate substanțial egală atom. În jurul nucleului, electronii se mișcă în orbite închise, formând coaja de electroni a atomului. Deoarece atomii sunt neutri, electronii Z ar trebui să se rotească în jurul nucleului, încărcarea totală a lui este Ze. Dimensiunile atomului sunt determinate de dimensiunile orbitelor exterioare ale electronilor. Masa electronilor este o fracțiune foarte mică din masa nucleului. Astfel, nucleul unui atom deține o mică fracțiune din volumul atomului și se concentrează aproape toate ( „99,95%), masa atomului. Rutherford a sugerat că atomul este aranjat ca un sistem planetar. Pe măsură ce în jurul Soarelui, la distanțe mari, se referă la planetă, electronii din atom se rotesc în jurul nucleului atomic. Raza cea mai îndepărtată orbită circulară de electroni, iar nucleul este raza atomului. Un astfel de model atomic a fost numit un model planetar. Modelul planetar al atomului explică legile fundamentale ale împrăștierii particulelor încărcate. Deoarece majoritatea spațiului în atom între nucleul atomic și electronii circulat în jurul goale particulele încărcate rapid pot penetra aproape liber segmente relativ mari de substanțe ce conțin mai multe mii de straturi atomice. În coliziuni cu electroni individuali, particulele încărcate rapid se împrăștie într-unghiuri foarte mari, deoarece masa electronilor este mică. Cu toate acestea, în acele cazuri rare când încărcate rapid de particule care zboară la o distanță foarte aproape de unul dintre nucleele atomice sub acțiunea câmpului electric poate avea loc împrăștierea particulelor încărcate la orice unghi de până la 180 ° Rezultatele experimentelor asupra dispersiei unui nucleu atomic - particulele favorizează nuclear Modelul Rutherford, însă modelul nuclear era în contradicție cu legile mecanicii clasice și a electrodinamicii. Deoarece sistemul de taxe fixe nu pot fi în starea de echilibru, Rutherford a trebuit să abandoneze modelul atomic static și sugerează că electronii se deplasează în jurul miezului, descriind o traiectorie închisă. Dar atunci electronul se va mișca cu accelerație, pentru că în funcție de electrodinamica clasică, trebuie să emită în mod continuu unde electromagnetice (lumină). Acest proces trebuie însoțit de o pierdere de energie și electronul trebuie să cadă în cele din urmă pe miez.
g). Cum, pe baza relației de incertitudine, se explică prezența lățimii naturale a liniilor spectrale?
Durata medie de viață a unui electron într-o stare instabilă excitată a unui atom. Aceasta este incertitudinea timpului, deoarece este imposibil să se precizeze exact momentul în care electronul trece la starea solului. Relația de incertitudine poate fi scrisă pentru energie și timp:. Prin urmare: toate nivelurile de energie ale stărilor excitate sunt "neclare" în benzi de lățime. Fotonii emise la tranziții identice cu starea solului,
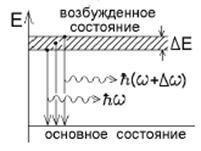
poate avea o frecvență diferită. Frecvența incertitudinii:. Toate liniile spectrale vor fi estompate în benzi de lățime :. Această lățime se numește lățimea naturală a liniei spectrale și nu poate fi redusă de nici un spectrograf, chiar dacă puterea de rezolvare este ideală.
Lățimea nivelului de energie a pământului, de vreme ce a găsit un electron pe el
2. Intensitatea valului luminii Ploskaya I = 0,70 W / sq. M.svesveschaetshar cu suprafata absolut oglinda. Radius shara = 5,0 cm. Găsiți forța de presiune ușoară pe care o resimți mingea cu ajutorul reprezentărilor corpusulare.

2. Pe baza faptului că primul potențial de excitație al atomului de hidrogen F1 = 10,2 V, determină energia fotonului corespunzător primei linii din seria Balmer.
Articole similare
-
Pot călători cu trenul pe un bilet electronic cu un bilet militar
-
Newchek - încasări de numerar, cecuri de mărfuri, hoteluri, bilete de autobuz, cecuri la benzinării
Trimiteți-le prietenilor: