Teoria și caracteristicile topirii
Metalele sunt diferite de celelalte solide prin prezența electronilor liberi. Acești electroni nu sunt asociați cu nici un atom particular și nu se mișcă în jurul metalului. Electronii liberi determină astfel de proprietăți ale metalelor, cum ar fi plasticitatea, conductivitatea electrică etc. Specificitatea stării metalice solide, în general, rămâne chiar după topire. Natura specială a așa-numitei legături metalice conduce la posibilitatea formării diferitelor cristale mixte (aliaje).
Procesul de topire a metalelor și a aliajelor este destul de complicat din cauza "suprapunerii" diferitelor fenomene fizico-chimice, totuși, esența sa este mai ușor de imaginat decât procesul de cristalizare. Acest lucru se explică prin faptul că topirea nu necesită formarea de nuclee, iar procesul de tranziție de la starea solidă la lichid începe imediat ce metalul sau aliajul este încălzit până la temperatura de pornire la topire.
Unele supraîncălziri deasupra punctului de topire sunt necesare pentru a începe topirea cristalului în interiorul acestuia. Topirea este un proces relativ simplu, de asemenea, deoarece aliajul lichid are o structură care nu depinde de condițiile de formare a acestuia.
În faza solidă a topiturii, practic nu există o redistribuire a substanțelor chimice.
Se știe că corpurile cristaline sunt caracterizate de o periodicitate strictă în aranjarea particulelor. În același timp, forțele care dețin atomi în locurile de zăbrele sunt foarte mici. Energia termică a atomilor înșiși este suficientă pentru a se abate de la poziția de echilibru prin distanțe apreciabile. Se constată că la temperaturi obișnuite magnitudinea vibrațiilor termice poate fi de 5-10% din distanța interatomică.
Cele mai importante metode de absorbție a energiei termice de către corpurile metalice solide sunt modalități de creștere:
1) intensitatea vibrațiilor atomilor,
2) energia mișcării translaționale a electronilor (excitarea lor);
3) energia mișcării de rotație a moleculelor.
Atunci când metalele și aliajele sunt încălzite de la temperatura obișnuită la punctul de topire, există o absorbție continuă a energiei, care este consumată pentru a crește intensitatea acestor oscilații și mișcări. Până în prezent, fiecare atom este în locul obișnuit și este înconjurat de un număr corespunzător de atomi apropiați situați la distanțe care corespund structurii perfecte. Dar vine un moment când aceste distanțe sunt încălcate sau numărul de atomi învecinați se schimbă la atom. Această perioadă de pre-topire se caracterizează printr-o creștere semnificativă a defectelor structurale de diferite tipuri.
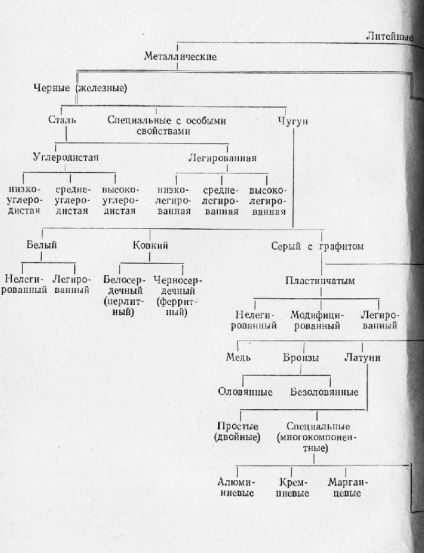
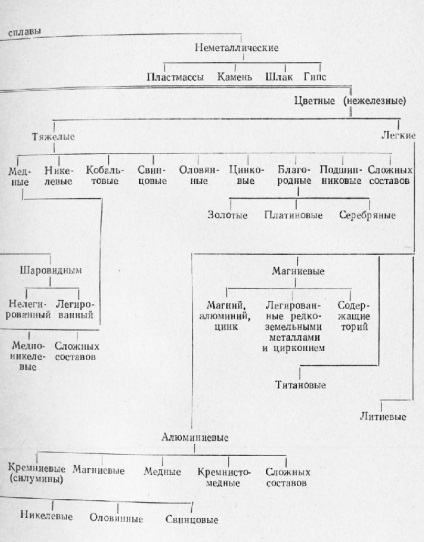
Schema 1. Clasificarea aliajelor de turnătorie
Din cele de mai sus rezultă că numărul de posturi vacante depinde, în principal, de temperatură. De exemplu, în aluminiu, o vacanță este de 1012 atomi la temperatura camerei și la un punct de topire de numai 103 de atomi. Pentru aluminiu, Ea = 0,75 eV. Trebuie remarcat faptul că prezența unui singur post vacant la 1000 de atomi este caracteristică metalelor solide în apropierea punctului de topire.
Caracteristica pretopire - intensificarea considerabilă a proceselor de difuzie - datorită faptului că atomii sunt în măsură să călătorească pe distanțe lungi, ca urmare a creșterii numărului și poziției mișcării lor.
Când se topește, stabilitatea termodinamică a laturilor cristaline și ordinea dispunerii atomilor (moleculelor sau ionilor) caracteristice stării solide sunt încălcate. Drept rezultat, corpurile cristaline solide pierd permanența formei, apare o schimbare bruscă (creștere) a energiei interne, a volumului, entropiei și a altor proprietăți fizice ale metalelor și aliajelor. Aliajele, spre deosebire de substanțele cu un singur component, se topesc într-un anumit interval de temperatură, în funcție de compoziția și presiunea lor.
Căldura generată în unitățile de topire care rezultă din arderea combustibilului sau alt proces, transferat încărcătura metalică solidă și în principal consumate pentru dilatarea termică, care este o consecință a creșterii mișcării de vibrație a atomilor față de pozițiile lor de echilibru normale.
Pe măsură ce crește temperatura, mișcările vibraționale cresc, iar corpul solid, care trece prin regiunea unor stări instabile, devine lichid. Pentru ca acest proces să se realizeze complet, cantitatea de căldură necesară pentru a asigura detașarea atomilor din poziția lor normală de echilibru și pentru a compensa diferitele pierderi de căldură ale proceselor care însoțesc topirea trebuie să intre în spațiul de lucru al cuptorului.
În consecință, topirea poate fi privită ca o tranziție de la o stare în care atomii din rețeaua cristalină sunt aranjați corespunzător într-o stare în care rețeaua este distrusă. De notat că trecerea la starea lichidă nu conduce întotdeauna la distrugerea completă a structurii cristaline. Cu toate acestea, în 1921, A. Lebedev a arătat că lichidele pot îndeplini anumite modalități de ordine ale moleculelor, care se manifestă în faptul că, în unele volum site-uri molecule ultramicroscopice forma cristalite dimensiune neglijabilă. Astfel de formări în lichide sunt detectate la temperaturi apropiate de punctul de topire. Distrugerea completă a resturilor de structură cristalină poate fi realizată numai prin creșterea temperaturii topiturii și expunerea lungă.
O caracteristică a multor procese de topire în topitorii este necesară pentru a obține încărcare solide temperatură de transformare într-o stare în care resturile dintr-o structură în stare solidă ar fi distrusă în cea mai mare măsură posibilă. Aceasta asigură obținerea, de exemplu, a proprietăților mecanice necesare în multe aliaje, în special în fontă.
În timpul topirii, volumul de metale crește cu 3-4%, ceea ce trebuie luat în considerare la studierea cristalizării turnărilor în matrițe.
Trebuie subliniat faptul că pentru calitatea viitoarei turnări nu este indiferent ce intensitate și în ce mediu are loc topirea și, de asemenea, ce nivel de supraîncălzire deasupra punctului de topire a fost atins în același timp. Acești factori pot avea ulterior o influență decisivă asupra procesului de cristalizare a turnării și a proprietăților sale finale. De exemplu, o influență mare asupra cristalizării este exercitată în particulele de topitură (substraturile) care formează interfața. Ele pot servi drept sursă de nucleare heterogenoasă a cristalelor. Pe această suprafață, dacă este umezită de metal lichid, nucleele se pot forma și formarea lor va necesita mai puțină energie. De mare importanță este unghiul de contact dintre substrat și nucleul fazei solide situate pe acesta.
Dacă unghiul de contact de umectare 0 este mic, atunci energia de suprafață a interfeței dintre faza solidă și substrat este de asemenea mică. În acest caz, nucleele fazei solide de pe suprafața substratului sunt ușor formate din atomii metalului lichid. Când 0 = 180 °, substratul nu afectează în mod semnificativ procesele de nucleare, deoarece energia interfacială la interfața dintre faza solidă și substrat se dovedește a fi suficient de mare.
Dacă unghiul de contact al umezelii este mic, nuclearea apare la o ușoară supracolire, dacă unghiul de contact este mare, este necesară o supracolire mare.
Practic, toate aliajele de turnătorie în stare lichidă conțin o anumită cantitate de impurități insolubile minute care pot afecta condițiile de cristalizare. De aceea, aliajele (în stare lichidă și solidă) trebuie atribuite sistemelor coloidale.
O caracteristică a sistemelor coloidale de acest tip este lidispersitatea lor. Natura sistemului rezultat și capacitatea acestuia de a interacționa cu unul sau altul sunt direct legate de condițiile de topire și supraîncălzire a metalului sau a aliajului. Multe aliaje de turnătorie, în special cele neferoase, conțin componente volatile. În industria de turnătorie, prin urmare, topirea în vid este larg utilizată. La orice temperatură peste zero absolută, toate substanțele, în principal lichide, se evaporă. Teoria moleculare-cinetică oferă o explicație pentru acest fenomen. Pe suprafața unui lichid sau a unui solid, energia moleculelor individuale este mult mai mare decât media pentru o temperatură dată. Această energie poate fi suficientă pentru a detașa moleculele și a le împrăștia în spațiul din jur. Rata de evaporare a unei substanțe este determinată de presiunea vaporilor acesteia, în funcție de temperatură, și presiunea externă a altor gaze (de exemplu, aerul) asupra substanței evaporatoare. Presiunea de vapori a substanței evaporatoare depinde de natura, temperatura și curbura suprafeței și este aproape independentă de presiunea altor gaze deasupra substanței evaporatoare. Cu toate acestea, rata de difuzie a aburului, care afectează rata generală de evaporare, scade odată cu creșterea presiunii gazului străin în sistem. Această circumstanță este luată în considerare și utilizată în procese de topire reale pentru a reduce pierderile componentelor volatile ale aliajului.
Rata de evaporare poate fi redusă în mod semnificativ dacă suprafața liberă a lichidului de evaporare este acoperită cu un strat de suprafață suficient de mare. Stratul de zgură de pe metalul lichid face ca evaporarea să fie dificilă și este de dorit în topirea convențională.
Cu un astfel de echilibru, numărul de molecule pe unitate de trib pe unitatea interfeței de la lichid la vapori, numărul de molecule trecând de la vapori la lichid. Elasticitatea saturației în vapori a fiecărei substanțe depinde numai de temperatură și crește odată cu creșterea acesteia. Eliminarea vaporilor de la suprafața de evaporare promovează constant „ventilație“ acestei suprafețe cauzate de diverse cauze (mișcarea flăcării, produsele de ardere a aerului și a semănat m. P.). Cu cât este mai mare turbulența fluxului de gaze pe corpul de evaporare, cu atât mai mult este eliminată vaporii și procesul de evaporare se desfășoară mai degrabă. Dacă presiunea saturată a vaporilor devine egală cu sau puțin mai mare decât presiunea externă, evaporarea se realizează nu numai de pe suprafața lichidului, ci și din interiorul acestuia. Aceasta creează bule de abur, crescând rapid și urcând la suprafață. Evaporarea se transformă în fierbere.
Studiul regularității fizico-chimice a evaporării are o mare importanță practică pentru topirea în condiții de vid.
Citește mai mult:
Articole similare:
Articole similare
Trimiteți-le prietenilor: