Legătura chimică covalentă, soiurile sale și mecanismele de educație. Caracteristică a legăturii covalente (polaritate și energie de legare). Legarea ionică. Îmbinarea metalică. Legătură hidrogen
Doctrina legăturilor chimice formează baza întregii chimii teoretice.
Prin legarea chimică se înțelege interacțiunea atomilor, care le leagă de molecule, ioni, radicali, cristale.
Există patru tipuri de legături chimice: ionice, covalente, metalice și hidrogen.
Împărțirea obligațiunilor chimice în tipuri este condiționată, deoarece toate se caracterizează printr-o unitate definită.
Legătura ionică poate fi considerată ca fiind un caz limitativ al unei legături covalente polar.
Legătura metalică combină interacțiunea covalentă a atomilor cu ajutorul electronilor socializați și atracția electrostatică dintre acești electroni și ionii metalici.
În substanțe, adesea nu există cazuri limitative de legare chimică (sau legături chimice pure).
De exemplu, fluorura de litiu $ LiF este denumită compuși ionici. De fapt, în ea, legătura este de 80% ionică și 20% covalentă. Prin urmare, este mai corect să vorbim despre gradul de polaritate (ionicitate) al legăturii chimice.
Printre halogenurile $ HF-HCl-HBr-HI HAT-grade $ polarității conexiune scade pentru reducerea diferenței în valorile electronegativitatea atomilor de halogen și hidrogen, și în comunicare acid astatinhidric devine $ aproape nepolari (EO (H) = 2,1; EA (La) = 2,2) $.
Diferite tipuri de legături pot fi conținute în aceleași substanțe, de exemplu:
- în baze: între atomii de oxigen și hidrogen din grupările hidroxi, legătura polară este covalentă și între grupul metalic și hidrox, legătura ionică;
- în săruri acide oxigenați: între atom și metaloid rest de acid oxigen - covalenta polar, între un metal și un rest de acid - ion;
- .. În săruri de amoniu, metilamoniu etc. între atomii de azot și hidrogen - covalentă polară și între ionii sau amoniu și reziduu de acid metilamoniu - ion;
- în peroxizi metalici (de exemplu, $ Na2O2), legătura dintre atomii de oxigen este covalentă nepolară și între metal și oxigen este ionică etc.
Diferite tipuri de link-uri pot fi transferate unul în altul:
- în timpul disocierii electrolitice în apă a compușilor covalenți, legătura polară covalentă devine ionică;
- în timpul evaporării metalelor, legătura metalică este transformată într-o legătură covalentă nepolară, etc.
Motivul pentru unitatea tuturor tipurilor și tipurilor de legături chimice este natura lor chimică identică - interacțiunea electron-nucleară. În orice caz, formarea unei legături chimice este rezultatul interacțiunii electron-nucleare a atomilor, însoțită de eliberarea energiei.
Metode de formare a unei legături covalente. Caracteristicile obligațiunilor covalente: lungimea legăturii și energia
O legătură chimică covalentă este o legătură care apare între atomi datorită formării perechilor electronice comune.
Mecanismul de formare a unei astfel de legături poate fi schimb și donator-acceptor.
I. Mecanismul de schimb acționează atunci când atomii formează perechi electronice comune datorită unificării electronilor nepartiți.
Conectarea se face datorită formării unei perechi electronice comune de atomi de hidrogen (care se suprapun $ s $ orbitale):
2) HCI $ - Hidrogen clorhidrat:
Conexiunea provine din formarea unei perechi comune de electroni de $ s- $ și $ p- $ electrons (suprapuse $ s-p- $ orbitals):
3) $ Cl_2 $: în molecula de clor, legătura covalentă se formează datorită electronilor nereparați $ p- $ (suprapunerea orbitalilor $ p-p- $):
4) $ N_2 $: într-o moleculă de azot între atomi, se formează trei perechi de electroni comune:
II. Mecanismul donor-acceptor pentru formarea unei legături covalente este luat în considerare pentru exemplul ionului de amoniu NH4 ^ +.
Donator are acceptor de electroni pereche - orbital liber pe care această pereche poate lua. Legătura de ioni de amoniu, cu toți cei patru atomi de hidrogen ai covalente trei formate prin crearea unei perechi de electroni comun de atomi de azot și atomi de hidrogen de pe mecanismul de schimb, unul - pentru mecanismul donor-acceptor.
Legăturile covalente pot fi clasificate prin metoda suprapunerii orbitalilor electronici și, de asemenea, prin mutarea lor la unul dintre atomii legați.
Legăturile chimice formate ca urmare a suprapunerii orbitalilor electronici de-a lungul liniei de comunicație sunt numite $ σ $ -connections (sigma-bonds). Legătura sigma este foarte puternică.
$ p- $ Orbital se poate suprapune în două regiuni, formând o legătură covalentă datorită suprapunerii laterale:
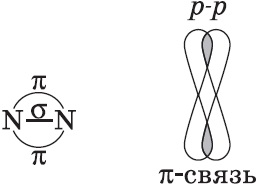
Legăturile chimice formate ca urmare a suprapunerii "laterale" a orbitalilor electronici în afara liniei de comunicație, adică în două domenii, se numesc $ π $ -connections (pi-connections).
Prin gradul de părtinire a perechilor electronice comune la unul dintre atomii lor conectați, legătura covalentă poate fi polară și nepolară.
O legătură chimică covalentă formată între atomi cu aceeași electronegativitate se numește nonpolar. Perechile de electroni nu sunt deplasate la nici unul dintre atomi, deoarece atomii au aceeași proprietate EO pentru a atrage electroni de valență de la alți atomi. De exemplu:
și anume printr-o legătură covalentă nepolară, se formează molecule simple de substanțe nemetalice. Legătura chimică covalentă dintre atomii elementelor ale căror electronegativități sunt diferite se numește polar.
Lungimea și energia legăturii covalente.
Proprietățile caracteristice ale unei legături covalente sunt lungimea și energia sa. Lungimea legăturii - distanța dintre nucleele atomilor. Legătura chimică este cu atât mai puternică, cu atât este mai mică. Cu toate acestea, o măsură de rezistență a legăturii este energia de legare. care este determinată de cantitatea de energie necesară pentru ruperea conexiunii. De obicei se măsoară în kJ / mol. Astfel, potrivit datelor experimentale, lungimea moleculelor $ H_2, Cl_2 $ și $ N_2 $ $ sunt, respectiv, 0,074, 0,198 și $ $ $ 0.109 nm și o energie de obligațiuni, respectiv, $ 436, $ 242 și $ 946 $ kJ / mol.
Ionii. Legarea ionilor
Să ne imaginăm că doi atomi sunt "întâlniți": un metal din grupa I și un atom dintr-un grup nemetalic VII. La atomul de metal, la nivelul energiei externe, există un singur electron, iar atomul ne-metalic lipsește doar un electron, astfel încât nivelul său extern este complet.
Primul atom va da cu ușurință secundul său departe de nucleu și de un electron slab legat, iar cel de-al doilea îi va da un spațiu liber la nivelul său electronic extern.
Apoi, atomul, lipsit de una din încărcăturile sale negative, devine o particulă încărcată pozitiv, iar a doua devine o particulă încărcată negativ datorită electronului obținut. Astfel de particule se numesc ioni.
Legătura chimică care apare între ioni se numește ionică.
Luați în considerare formarea acestei conexiuni prin exemplul unui bine cunoscut compus al clorurii de sodiu (sare obișnuită):
Procesul de conversie a atomilor în ioni este reprezentat pe diagrama:
O astfel de conversie a atomilor în ioni are loc întotdeauna atunci când atomii de metale tipice și nonmetali tipici interacționează.
Luați în considerare un algoritm (secvență) de raționament atunci când înregistrați formarea unei legături ionice, de exemplu, între atomi de calciu și clor:
- Calciul este un element al principalului subgrup al grupului II, metal. Atomul său este mai ușor să dea doi electroni externi decât să ia șase care lipsesc: $ ↙-2e↖ → Ca ^ ↙ $.
- Clorul este un element al principalei subgrupuri din grupa VII, nemetal. Atomul său este mai ușor să accepte un electron, care îi lipsește înainte de finalizarea nivelului exterior, decât să renunțe la șapte electroni de la nivelul exterior: $ ↙ + 1e↖ → Cl ^ ↙ $.
- Mai întâi, găsim cel mai mic număr comun dintre încărcăturile ionilor formați, este egal cu $ 2 (2 · 1) $. Apoi determinăm cât de mulți atomi de calciu trebuie luați pentru a renunța la doi electroni, adică trebuie să luăm un atom de $ Ca $ și câți atomi de clor trebuie să fie luați astfel încât să poată primi doi electroni, adică trebuie să luăm doi atomi $ Cl $.
- Schematic, formarea unei legături ionice între atomi de calciu și clor poate fi scrisă după cum urmează:
Cifrele care arată numărul de atomi sau molecule se numesc coeficienți. iar numerele care arată numărul de atomi sau ioni dintr-o moleculă se numesc indici.
Îmbinarea metalică
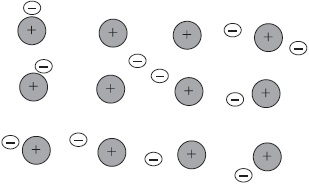
Vom cunoaște modul în care atomii de elemente metalice interacționează între ei. Metalele nu există de obicei sub formă de atomi izolați, ci sub formă de bucată, lingou sau produs metalic. Ce păstrează atomii metalului într-un singur volum?
Atomii majorității metalelor la nivelul exterioară conțin un număr mic de electroni - $ 1, 2, 3 $. Acești electroni sunt detașați cu ușurință, iar atomii sunt transformați în ioni pozitivi. Electronii detașați se mișcă de la un ion la altul, legându-i într-un singur întreg. Conectând cu ionii, acești electroni formează temporar atomi, apoi se rup din nou și se conectează cu un alt ion etc. În consecință, în volumul atomilor de metal sunt transformați în mod continuu în ioni și invers.
Legătura dintre metale dintre ioni prin intermediul electronilor socializați se numește metalică.
Figura prezintă schematic structura fragmentului metalic de sodiu.
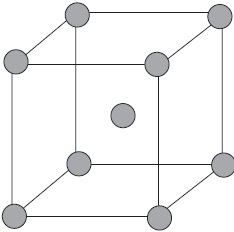
În acest caz, un număr mic de electroni socializați leagă un număr mare de ioni și atomi.
Legătura metalică are unele asemănări cu legătura covalentă, deoarece se bazează pe socializarea electronilor externi. Cu toate acestea, în legătura covalentă, electronii externi nepărați ai numai doi atomi învecinați sunt socializați, în timp ce pentru legătura metalică toți atomii participă la socializarea acestor electroni. De aceea, cristalele cu o legătură covalentă sunt fragile și cu o legătură metalică, de regulă, din plastic, cu conductivitate electrică și cu o strălucire metalică.
Legătura metalică este caracteristică atât pentru metale pure, cât și pentru amestecuri de metale - aliaje în stare solidă și lichidă.
Legătură hidrogen
Liantul chimică între atomii polarizată pozitiv de hidrogen ai unei molecule (sau o porțiune a acesteia) și atomii polarizate negativ puternic elementele electronegative având perechi de electroni neîmpărtășite ($ F, O, N $ și mai rar $ S $ și $ CI $), o altă moleculă (sau a părți) se numește hidrogen.
Mecanismul formării legăturii de hidrogen are un caracter parțial electrostatic, parțial donator-acceptor.
Exemple de legare la hidrogen intermolecular:
În prezența unei astfel de legături, chiar și substanțele moleculare mici pot fi lichide (alcool, apă) sau gaze ușor lichefiate (amoniac, hidrogen fluorură) în condiții normale.
Substanțele cu o legătură de hidrogen au laturi cu cristale moleculare.
Substanțe cu structură moleculară și non-moleculară. Tip de zăbrele de cristal. Dependența proprietăților substanțelor de compoziția și structura lor
Structura moleculară și non-moleculară a substanțelor
Interacțiunile chimice nu implică atomi sau molecule individuale, ci substanțe. Substanța în condițiile date poate fi în una din cele trei stări agregate: solidă, lichidă sau gazoasă. Proprietățile unei substanțe depind, de asemenea, de natura legăturii chimice dintre particulele constituente - molecule, atomi sau ioni. Prin tipul de legătură, se disting substanțe de structură moleculară și non-moleculară.
Substanțele constând din molecule se numesc substanțe moleculare. Contactul dintre moleculele din aceste substanțe este foarte slabă și mult mai slabă decât cea dintre atomii din moleculă și la temperaturi relativ scăzute, acestea sunt rupte - materialul devine un lichid și în gazul (sublimarea iod). Punctele de topire și de fierbere ale substanțelor formate din molecule cresc cu creșterea greutății moleculare.
Substanțele moleculare includ substanțe cu structură atomică ($ C, Si, Li, Na, K, Cu, Fe, W $), dintre care există metale și nemetalice.
Să luăm în considerare proprietățile fizice ale metalelor alcaline. Rezistența relativ mică a legăturii dintre atomi determină o rezistență mecanică scăzută: metalele alcaline sunt moi, ușor de tăiat cu un cuțit.
Dimensiunile mari ale atomilor conduc la o densitate scăzută a metalelor alcaline: litiul, sodiul și potasiul sunt chiar mai ușoare decât apa. În grupul de metale alcaline, punctele de fierbere și topire scad cu ordinea în creștere a elementului, deoarece dimensiunile atomilor cresc, iar legăturile se slăbesc.
Compușii ionici aparțin substanțelor dintr-o structură nonmoleculară. Astfel, structura are cea mai mare dintre compușii metalelor din nemetalelor: toate sărurile ($ NaCl, K_2SO_4 $), unele hidruri ($ LiH $) și oxizi ($ CaO, MgO, FeO $), o bază ($ NaOH, KOH $). Substanțele ionice (non-moleculare) au puncte de topire și puncte de fierbere ridicate.
Grile de cristal
Substanța, după cum se știe, poate exista în trei stări agregate: gazoasă, lichidă și solidă.
Solide: amorf și cristalin.
Să analizăm modul în care caracteristicile legăturilor chimice afectează proprietățile substanțelor solide. Substanțele solide sunt împărțite în cristale și amorfe.
Substanțele amorfe nu au un punct de topire limpede - când sunt încălzite, acestea se înmoaie treptat și intră într-o stare fluidă. Într-o stare amorfă, de exemplu, există plastilină și diverse rășini.
materiale cristaline sunt caracterizate printr-un aranjament regulat al particulelor din care acestea constau: din atomi, molecule și ioni - în puncte strict definite în spațiu. Atunci când aceste puncte sunt unite prin linii drepte, se formează un cadru spațial, numit o latură de cristal. Punctele în care sunt plasate particulele de cristal se numesc zone de zăbrele.
În funcție de tipul de particule situate la nodurile laturii cristaline și de natura relației dintre ele, există patru tipuri de laturi cristaline: ionice, atomice, moleculare și metalice.
Grile cristal ionice.
Cristalele ionice se numesc laturi cristaline, în care sunt localizați ionii. Acestea sunt formate din substanțe cu o legătură ionică, care poate fi legată atât de ioni simpli, cât și de complexul de SO4 ^, OH ^ - $. În consecință, rețelele de cristal ionic au săruri, niște oxizi și hidroxizi ai metalelor. De exemplu, un cristal de clorură de sodiu constă din ioni pozitivi alternativi $ Na ^ + $ și negativi $ Cl ^ - $, care formează o latură sub forma unui cub. Legăturile dintre ioni dintr-un astfel de cristal sunt foarte stabile. Prin urmare, substanțele cu o latură ionică sunt caracterizate printr-o duritate și rezistență relativ ridicate, ele sunt refractare și non-volatile.
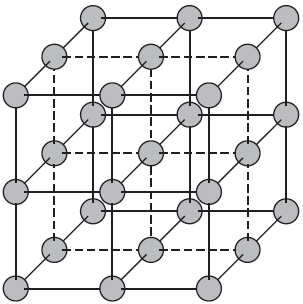
Grile cristaline atomice.
Cristalele atomice sunt numite laturi, la nodurile cărora există atomi individuali. În astfel de laturi, atomii sunt interconectați prin legături covalente foarte puternice. Exemple de substanțe cu acest tip de barilor de cristal poate fi diamant - una dintre modificările alotropice carbon.
Cele mai multe substanțe cu o latură de cristal atomic au puncte de topire foarte ridicate (de exemplu, în diamante este de peste 3.500 ° C), sunt puternice și dure, practic insolubile.
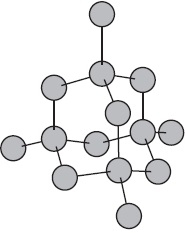
Mărimea cristalului molecular.
Chemat Grile moleculare, care sunt situate la nodurile moleculei. Legăturile chimice din aceste molecule pot fi polar ($ HCl, H_2O $) și nonpolar ($ N_2, O_2 $). În ciuda faptului că atomii din interiorul moleculelor sunt legați de legături covalente foarte puternice, moleculele slabe de atracție intermoleculară acționează între moleculele în sine. Prin urmare, substanțele cu laturi cu cristale moleculare au duritate scăzută, puncte de topire scăzute și substanțe volatile. Majoritatea compușilor organici solizi au grile de cristal molecular (naftalină, glucoză, zahăr).

Grilaje de cristal metalic.
Substanțele cu o legătură metalică au laturi metalice de cristal. Nodurile acestor latici sunt atomi și ioni (atomi care, ionii sunt transformați ușor la atomii metalici, dând electronii lor exterioare „în uz general“). O astfel de structură internă a metalelor determină proprietățile fizice caracteristice: ductilitatea, plasticitatea, conductivitatea electrică și termică, luciul metalic caracteristic.
Articole similare
Trimiteți-le prietenilor: