Cum virusul pătrunde în celulă
Yurii Aleksandrovici Chizmadzhev, Corr. RAS, D.Ch. n. prof. Departamentul de Biofizică, Universitatea de Stat din Moscova,
Șef al Laboratorului de Bioelectrochimie al Institutului de Electrochimie AN Frumkin, Academia Rusă de Științe.
După cum știți, celula conține un număr mare de formațiuni de membrană - de la vezicule izolate la o rețea continuă de reticul endoplasmic. Și întregul sistem se află într-o stare de restructurare permanentă, care include mai multe acte de fuziune și divizare. Deci, în aparatul Golgi, proteina este ambalată în recipiente pentru vezicule, care se îmbină cu membrana plasmatică. Acest lucru completează procesul de exocitoză. Un alt exemplu este fuziunea membranei sinaptice și a veziculelor secretoare cu neurotransmițători, rezultând în transmiterea unui impuls nervos, unul dintre principalii purtători de informații.
Livrarea de particule mari în interiorul celulei este efectuată prin endocitoză. Celula înghite particulele din mediul extern, care sunt învelite de o porțiune din membrana plasmatică, se formează o depresiune, podul este distrus și recipientul este în interiorul celulei. Dezasamblarea lui este o altă poveste și rămâne să subliniem că atât endocitoza cât și exocitoza sunt mediate de o varietate de proteine a căror natură și mecanism de acțiune nu sunt pe deplin stabilite.
În plus față de fuziunea "utilă", celula întâmpină adesea cazuri de îmbinare "dăunătoare". De exemplu, atunci când este atacat de un virus, care este suficient să spună: "Open, open!", Și plicul lipidic al virusului se îmbină cu membrana plasmatică. Aceasta formează așa-numitul timp de fuziune, iar ADN sau ARN viral începe să găzduiască în interiorul celulei. Din motive de justiție, trebuie remarcat faptul că capacitatea unică a virușilor de a "deschide seifurile" este deja folosită în beneficiul organismului. În terapia genică, sunt selectați viruși antiefracți inofensivi, cărora li se creează o genă utilă, capabilă să ajute celula bolnavă.
Este extrem de dificil de înțeles mecanismul fizic al fuziunii obiectelor biologice. Ca întotdeauna, în astfel de cazuri sistemele de model ajung la salvare. Referindu-se la trecutul recent, trebuie subliniat faptul că la mijlocul anilor 80 au fost realizate câștiguri impresionante în studiul mecanismului de fuziune a lipidelor bilayers [1]. Cu toate acestea, pe la mijlocul anilor 90 a relevat: intermediari ai procesului de luat în modelele teoretice, au energie de mare, astfel încât viteza de proiectare, contrar datelor experimentale, este neglijabilă. În plus, deși sa demonstrat că proteinele speciale joacă un rol esențial în cursul fuziunii, nu a fost clar ce fac ei. Lucrarea experimentală și teoretică a laboratorului nostru, desfășurată în a doua jumătate a anilor '90, a fost dedicată rezolvării acestor probleme.
Calea virusului în cușcă
Lumea virușilor este foarte diversă. Lucrul obișnuit pentru aceștia este că orice material ereditar (sub formă de ADN sau ARN) este ambalat cu grijă într-un costum protector de proteine. Particulele virale (virionii) diferă în formă și dimensiune. Astfel, diametrul virionilor sferici este de la 20 la 300 nm. Anumiți viruși au un strat suplimentar de lipide, care include proteine specializate care promovează fuziunea membranelor. Astfel de viruși sunt numiți virusuri de coajă. Cerințele pentru stratul proteic lipidic sunt duale. Pe de o parte, trebuie să protejeze materialul ereditar de vicisitudinile soartei și, pe de altă parte, este ușor să se dezintegreze când virusul începe o viață activă în interiorul celulei victimă.
Virușii plicului pătrund în celulă în două moduri. În primul caz, virusul se leagă de receptorii de suprafață celulară, apoi, ca rezultat al endocitozelor, veziculele care conțin virionul sunt înmugurite. În această stare, virusul este împachetat într-o membrană suplimentară formată de membrana celulară. Din a doua carcasă, atunci când acesta este eliberat de la confluenta endosome veziculă, în care mediul acid activează proteinele de fuziune și contribuie astfel la unificarea cu membrana endosomală a virionului. Ca rezultat, materialul ereditar intră în citoplasmă și poate ajunge la nucleu. În primele etape ale acestui proces, inclusiv penetrarea în endosom, virusul joacă un rol pasiv. Aici se folosește mecanismul obișnuit de endocitoză, iar celula de încredere nu știe nici măcar ce pericol se ascunde în sine prin acest "dar al soartei". Și numai o singură dată în endosom, virusul activează și ia întregul joc pe sine, provocând fuziunea cochiliei sale cu membrana endosomală. Acesta este modul în care funcționează bine-cunoscut virusul gripal.
Două căi de penetrare a virusului încapsulat în celulă.
Endocitoză stângă și fuziune în endosom: 1 - virus, 2 - endosom, 3 - nucleu.
Corect - fuziune cu membrana plasmatică.
Alte virusuri, cum ar fi virusul imunodeficienței umane (HIV), nu este nevoie să activeze la pH scăzut și pătrunde în celulă într-un mod mai simplu, în care cochilia fuziona imediat cu membrana plasmatică, iar materialul ereditar este o celulă. Acum, el poate ajunge doar la miez.
Astfel, în orice caz, evenimentul cheie în lupta virusului învelit cu celulă este fuziunea anvelopei sale lipidice cu membrana plasmatică sau lizozomală. Este cea mai importantă etapă de infectare a celulei cu care este dedicată povestea noastră. Mai exact, vom vorbi despre virusul gripal A. Datorită particularităților structurii sale, sa dovedit a fi cel mai convenabil obiect pentru studiul experimental al mecanismului de fuziune.
Acest virus al cochiliei are o formă aproximativ sferică, cu un diametru de aproximativ 0,13 microni. În partea sa centrală există molecule de ARN și o serie de proteine necesare virusului în primele etape ale vieții în celulă. Miezul virionului este înconjurat de un strat de proteină M1, urmată de o membrană lipidică. Membrana proteică, încastrată în membrana lipidică, seamănă cu o plasă de pescuit atașată de picior. Mărimea celulelor din rețeaua de proteine este de aproximativ 4 4 4 nm 2. astfel încât un astfel de "pește", cum ar fi complexul de proteină ARN, nu poate trece prin ele. Membrana lipidică este formată din membrana plasmatică a celulei infectate atunci când virusul sintetizat este înmuiat. În această membrană sunt ancorate trei proteine: neuraminidază (H), canal ionic M2 și hemaglutinină (HA). Când mediul este acidificat, canalul ionic din interiorul virionului scade pH-ul, ceea ce duce la distrugerea coajei proteice a M1. În același timp, se activează hemaglutinina, principala componentă a "mașinii de confluență". În cursul activității sale, membranele virusului și celulelor sunt închise, iar calea spre citoplasma străină se deschide în citoplasmă.
Schema virionului de gripă:
HA - hemaglutinină, canal de ioni M2, H - neuraminidază, membrană de proteină M1.
Pe suprafața plicului viral, hemaglutinina este prezentă ca trimer. Fiecare dintre moleculele sale constă din două subunități: GA1, care asigură contact primar cu celula țintă și GA2, responsabilă de fuziune. În starea inițială, neutră (la pH7), toți trimerii sunt orientați aproximativ perpendicular pe suprafața membranei, gradul lor
13 nm. Fiecare moleculă de HA este ferm ancorată în membrana sale și care este foarte important, este compus dintr-un scurt (25 de aminoacizi), peptidă care este la pH 7 este ascuns în interiorul trimerul și este localizat aproape de baza de proteine. După reducerea pH-ului 7-5 molecula de hemaglutinină rearanjat la nivel global și peptida de fuziune nu este pur și simplu merge liber și este mutat la capătul cel mai de sus al moleculei și pătrunde în membrana victimei.
Structura hemaglutininei în stările inițiale (pH7) și în starea activă (pH5).
Culoarea peptidei este o fuziune, care își schimbă conformația într-un mediu acid.
Într-un mediu neutru, molecula de hemaglutinină seamănă cu un arc prins cu un zăvor, al cărui rol este jucat de peptida de fuziune ascunsă în "buzunarul hidrofob" al trimerului. Dar este necesar să se coboare pH-ul la 5, pe măsură ce peptida părăsește confluența și molecula GA poate intra într-o nouă stare de conformație. Judecând după măsurători, energia eliberată este destul de mare, dar nu este încă suficientă pentru a apropia celulele și virușii. Pentru a rezolva această problemă, moleculele de hemaglutinină nu acționează individual, ci colectiv. Așa cum s-a arătat prin experimente, în timpul interacțiunii virusului cu celula țintă, se formează rozete de șase până la opt trimeri, în interiorul fiecăruia sunt regiuni lipidice curbate cu o rază
10 nm. Cu ajutorul studiilor electron-microscopice și electrofiziologice, a fost posibilă detectarea unor astfel de umflături locale, numite dimple [2].
Aici se află, pe vârfurile crăpăturilor, rearanjarea lipidică, care duce la formarea porilor de fuziune. Modelul teoretic al procesului [3] este după cum urmează: proteine de fuziune, membrana îndoind nu numai că le aduce mai aproape, dar, de asemenea, furnizează energie, facilitând formarea unei pânze de monostrat - urmăritor; Lipidele din monostraturile de la distanță sunt deformate fără costuri mari de energie. Ca rezultat, se formează noi structuri intermediare - intermediari cu consum redus de energie care asigură o fuziune.
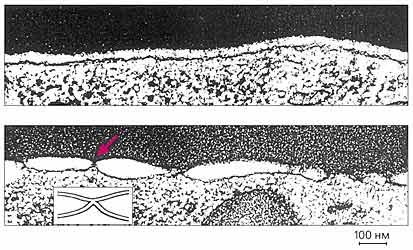
Formarea de gropi între membranele eritrocitelor și celulele care exprimă hemaglutinina.
Deasupra marginii membranelor de eritrocite și celule care exprimă GA, pH 7,4;
mai jos - la fel, dar pH-ul 4,9 - un număr mare de zone de contact (săgeată de culoare) este vizibil.
Bara laterală prezintă diagrama de contacte.
Sub fuziunea celulelor, a virușilor sau a organelurilor celulare se înțelege unificarea volumelor de apă legate de membrană și a membranelor în sine. Pentru a monitoriza acest proces, se utilizează etichete fluorescente solubile în lipide. Dacă o astfel de etichetă este conținută inițial în celulele A, atunci apariția ei în celulele lui B indică o fuziune. Adevărat, există cazuri când există o așa-numită semi-conștiință, adică Numai monostraturile exterioare ale celulelor sunt reunite, apropiate în zona contactului local. Pentru a distinge cazurile de fuziune semi- și completă, un colorant solubil în apă este introdus în celulele A. Fluxul său de la o celulă la alta indică o fuziune completă cu formarea porului prin care se realizează comunicarea. Astfel, în experiment, fuziunea în masă este studiată, de exemplu într-o suspensie de viruși și celule. Cu toate acestea, posibilitățile acestei tehnici sunt limitate, cu ajutorul căruia este dificil să se înțeleagă detaliile procesului, inclusiv formarea contactului local, apariția porului și dezvoltarea lui. Activități similare pot fi rezolvate numai cu ajutorul unei metode mai precise care vă permite să monitorizați obiecte unice, adică utilizând metode de microscopie fluorescentă și electrofiziologie modernă. Acest lucru a fost făcut mai întâi când a fost studiat exocitoza în celulele mastocitare utilizând tehnici microelectronice.
Într-un experiment tipic pentru fuziunea celulelor HAb2 și eritrocitelor, atunci când soluția înconjurătoare este acidulată la pH5, se formează un por. Prin aceasta, un curent capacitiv curge, care percepe celulele roșii din sânge. Schimbarea sa în timp reflectă expansiunea fuziunii porilor. În același timp, un colorant curge din membrana eritrocitelor în membrana HAb2. Comparând cele două curbe (conductivitatea și intensitatea fluorescenței) ca o funcție a timpului, observăm că al doilea este considerabil în spatele primului. Se presupune că această întârziere este cauzată de o ieșire a proteinei de la trimerii de hemaglutinină, care formează un fel de barieră în fluxul sondei lipidice. Perioada primară de fuziune se formează în regiunea lipidelor lipidice. Prin urmare, prin schimbarea compoziției lipidice a membranelor, este posibil să se influențeze întregul proces. Atunci când se apropie de bilaterul lipidic, se poate forma un jumper între monostraturile din apropiere (așa-numitul tulpină), germenul viitorului por. Probabilitatea formării sale depinde în mod semnificativ de compoziția lipidelor. De exemplu, introducerea lizofosfatidilcolinei (LPC) în monostraturi, chiar și în concentrații mici, inhibă complet fuziunea. Experimentele din sistemul HAb2-eritrocite au arătat că lizofosfatidilcolina este la fel de eficientă ca și în sistemele lipidice model. Cu alte cuvinte, timpul de fuziune după administrarea LPC nu apare deloc, deși, judecând după apariția fluorescenței, monostraturile se combină.
Curbele de conductivitate a porilor (culoare) și intensitatea fluorescenței.
Deasupra - control,
de mai jos - același sistem, dar cu adăugarea de lizofosfatidilcolină.
Ordonata este conductivitatea, abscisa este timpul.
Deci, moleculele de hemaglutinină pregătesc un câmp pentru jocurile lipidice. Dar acest lucru nu se oprește aici, proteinele participă și la etapele ulterioare. În experimentele speciale, atunci când activitatea proteinei scade (de exemplu, gradul de acidifiere al soluției scade), în loc să se controleze complet și să se formeze un por, se produce semi-digestia; Sondă lipidică este redistribuită între celule, dar nu există curent. Acest lucru înseamnă că, chiar și după formarea contactelor și formarea unui jumper, proteina face o treabă necesară pentru apariția porului. Astfel de rezultate importante au fost obținute în grupul lui L. V. Chernomordik de la Institutul Național de Sănătate (SUA), iar măsurătorile electrofiziologice au fost efectuate de către angajatul laboratorului nostru VA Frolov [4]. Rezultatele experimentelor în combinație cu modelele teoretice ne-au permis să propunem o anumită schemă a procesului de fuziune, care include patru etape.
Schema procesului de fuziune.
După scăderea pH-ului, se formează un orificiu de fuziune (1)
care promovează formarea unui contact local cu membrana (2)
și un pod, care apoi se transformă într-un timp de îmbinare (3, 4).
Cu toate acestea, orice model este întotdeauna diferit de obiectul real. Membrana celulei HAb2 are o compoziție lipidică diferită față de membrana virion, iar densitatea hemaglutininei este diferită, iar celula HAb2 nu conține proteine M1 și M2. Tehnica dezvoltată în laboratorul nostru face posibilă studierea fuziunii unui singur virion cu o membrană lipidică bilaterală [5]. Într-un mediu neutru (soluție tampon cu pH 7), virionii sunt injectați, dintre care unii sunt adsorbiți pe bistratificator. După aceea, o micropipetă, umplută cu o soluție cu pH5, este presată pe membrana plană. Deoarece vârful pipetei are o rază
1 micron, este foarte probabil ca unul sau mai mulți virioni să apară în interiorul acestuia, pe plasturele lipidic, în membrana căruia este inclusă o sondă fluorescentă în concentrația de auto-extincție. Un pH scăzut în interiorul pipetă inițiază fuziunea, iar sonda se difuzează în două straturi. Rezultatul diluției rezultă în fluorescență, care poate fi înregistrată.
Schema configurației experimentale. Detalii în text.
Măsurătorile electrice au arătat că, împreună cu debitul lateral al sondei, există un curent electric fluctuant care curge prin timpul de fuziune și unele structuri conductive din membrana virusului. Experimentele speciale au arătat că acesta este cazul în acest fel [6]. În aceste experimente, canalele ionice ale M2 au fost blocate cu amantadină, iar acidificarea în virion a fost realizată prin scăderea pH-ului (până la 5) în compartimentul inferior al celulei. Evident, cu o astfel de declarație a experimentului imediat după confluență, protonii din compartimentul inferior trebuie să se grăbească în virion prin porii de deschidere, ceea ce va distruge carcasa proteică din M1 chiar și cu canalele blocate M2. Într-adevăr, în aceste condiții, activitatea electrică apare, exact la fel ca în cazul canalelor deschise M2. Prin urmare, în acest fel este posibil să se urmeze nu numai evoluția porilor de fuziune în membrana lipidică, ci și distrugerea scheletului proteic. Acest lucru este extrem de important, deoarece randamentul materialului genetic al virusului în citoplasmă este limitat de ambele plicuri protectoare - proteine și lipide.
Astfel, combinând metodele de microscopie electronică și electrofiziologie, a fost posibil să se detecteze contactele locale ale membranei (dimples). Introducerea lizolipidei inhibă fuziunea biologică, ceea ce demonstrează că primul intermediar al procesului, ca și în sistemele model, este jumperul (tulpina).
Tehnica dezvoltată pentru studierea fuziunii virionilor unici cu biliari lipidici ne permite să studiem cinetica acestui proces, iar modelul de fuziune, folosind în principal noi intermediari, rezolvă problema "crizei energetice".
Explicarea rolului lipidelor și proteinelor într-un astfel de proces nu este doar de interes cognitiv. În viitor, acest lucru este important pentru dezvoltarea de noi metode de terapie antivirală.
Rezultatele au fost obținute pe parcursul studiilor susținute prin granturi RFBR:
Nr. 93-04-20590, nr. 96-04-50779, nr. 99-04-48427 și nr. 02-04-48287.
1. Chernomordik L.V. Melikyan G.B. Chizmadzhev Yu.A. // Biol. membrană. 1987. T.4. S.117-164.
Trimiteți-le prietenilor: