Proteinele protectoare ajută la protejarea organismului împotriva invaziei bacteriilor sale atacătoare, a virușilor și a penetrării proteinelor străine (denumirea generalizată a organismelor străine este antigeni).
Rolul proteinelor protectoare este realizat de imunoglobuline (un alt nume este anticorpii), ei recunosc antigenii care au pătruns în organism și sunt strâns asociați cu aceștia.
La mamifere, inclusiv oameni, există cinci clase de imunoglobuline: M, G, A, D și E, structura acestora, după cum sugerează și numele, globular, în plus, toate acestea sunt construite în același mod. organizare moleculară a anticorpilor este prezentat pe diapozitiv pentru clasa exemplu de imunoglobulină G. cuprinde patru lanțuri de polipeptide, combinate cu trei disulfurice S-S (pe diapozitiv sunt prezentate cu legături de valență îngroșate și simboluri mari S), mai mult decât atât, fiecare lanț de polimer cuprinde un punți disulfurice.
Două lanțuri polimerice mari (evidențiate în albastru) conțin 400-600 de resturi de aminoacizi.
Celelalte două lanțuri (evidențiate în verde) sunt aproape la jumătate de lungime, conțin aproximativ 220 de resturi de aminoacizi. Toate cele patru lanțuri sunt aranjate astfel încât grupurile terminale de H2N sunt direcționate într-o singură direcție.
După contactarea organismului cu o proteină străină (antigen), celulele sistemului imunitar începe să producă imunoglobuline (anticorpi) care se acumuleaza in ser. În prima etapă, zonele de lucru de bază face lanțuri conținând terminale H2N (în fig. 27 care corespunde porțiunilor marcate cu un verde și albastru deschis lumină). Aceasta este zona de captare a antigenilor. În timpul sintezei imunoglobulinei aceste porțiuni este formată în așa fel încât structura și configurația în care este posibil în concordanță cu structura care se apropie de antigen (ca o cheie pentru blocare, cum ar fi enzimele, dar problema în acest caz este diferit). Astfel, pentru fiecare antigen individual răspuns imun strict anticorp generat. O astfel de „plasticitate“ pentru a schimba structura în funcție de factori externi, în plus față de imunoglobuline, nu poate orice proteină cunoscută. Enzimele rezolva problema de reactiv conformitate structurală într-un alt mod - cu ajutorul unui set gigant de enzime diferite, în funcție de toate ocaziile posibile, și de fiecare dată din nou reconstrui imunoglobulinele un „instrument de lucru“. Mai mult decât atât, porțiunea de balama oferă două domenii de imunoglobulină captura unele mobilitate independentă, ca urmare a unei molecule de imunoglobulină poate „găsi“ crustaceul acțiune dreapta două cele mai convenabile pentru prinderea site-ul de pe antigen, în scopul de a remedia problema cu fermitate, fiind amintit.
În continuare este inclus un lanț de reacții succesive ale sistemului imunitar, imunoglobulinele legate de alte clase, care rezultă în dezactivarea proteinei străine, și apoi distrugerea și îndepărtarea antigenului (microorganism străin sau toxine).
După contactul cu antigenul, se atinge concentrația maximă de imunoglobulină (în funcție de natura antigenului și de caracteristicile individuale ale organismului însuși) timp de mai multe ore (uneori câteva zile). Corpul își păstrează memoria unui astfel de contact și, după atacul repetat de același antigen, imunoglobulinele se acumulează în serul de sânge mult mai rapid și în cantitate mai mare - se obține imunitatea dobândită.
Clasificarea de mai sus a proteinelor are într-o anumită măsură, condiționată, de exemplu proteina trombină, printre numitele proteine protectoare este în mod substanțial o enzimă care catalizează hidroliza legăturilor peptidice, adică aparține unei clase de proteaze.
Proteinele protectoare sunt adesea denumite proteine de venin de șarpe și proteine toxice ale unor plante. deoarece sarcina lor este de a proteja organismul de daune.
Există proteine ale căror funcții sunt atât de unice încât face dificilă clasificarea acestora. De exemplu, proteina monellin, conținută într-una din planta africana, - un gust foarte dulce, a devenit un subiect de studiu ca un material netoxic, care poate fi folosit în loc de zahăr pentru a preveni obezitatea. Plasma sanguină a unor pești antarctici conține proteine cu proprietăți antigel, care protejează sângele acestor pești de îngheț.
Proprietățile de protecție sunt posedate de proteinele din sistemul de coagulare a sângelui. de exemplu, fibrinogen, trombină. Ei participă la formarea unui tromb care înfundă vasul deteriorat și previne pierderea de sânge.
Proteinele contractile și motoare dau corpului capacitatea de a contracta, de a schimba forma și de a se mișca, mai presus de toate, este vorba de mușchi. 40% din masa tuturor proteinelor conținute în mușchi este myosin (cap, myos, greacă - mușchi). Moleculele sale conțin atât o parte fibrilară, cât și o parte globulară.
Astfel de molecule sunt combinate în agregate mari care conțin 300-400 de molecule.
Atunci când concentrația de ioni de calciu în spațiul din jurul fibrelor musculare se schimbă, apare o schimbare reversibilă în conformația moleculelor - o schimbare a formei lanțului datorită rotirii fragmentelor individuale în jurul legăturilor de valență. Acest lucru duce la o reducere și relaxare a mușchilor, semnalul pentru schimbarea concentrației de ioni de calciu provine de la terminațiile nervoase din fibrele musculare. contracția musculară artificială poate fi cauzată de acțiunea impulsuri electrice, ceea ce duce la o schimbare bruscă a concentrației de ioni de calciu, acest lucru se bazează pe stimularea mușchiului inimii pentru a restabili functiei cardiace.
Datorită alunecare una față de cealaltă actinei (actina) și protofibrils miozinei (myosin) are loc contracția musculară, precum și reducerea intracelulara non-musculare. Mișcarea cilia și a flagelului este asociată cu alunecarea microtubulilor, care sunt de natură proteică în natură, relativ unul față de celălalt.
Unele pești din Arctica și Antarctica conțin proteine în sânge - antigel, împiedicând înghețarea acestuia.
Unele proteine în îndeplinirea funcțiilor lor dau celulei capacitatea de a contracta sau de a se muta. Aceste proteine includ proteine actinice și myosin - fibrilare implicate în reducerea mușchilor scheletici. Un alt exemplu de astfel de proteine este tubulina, din care sunt construite organele celulare - microtubuli. Microtubulii în timpul divizării celulelor reglează discrepanța dintre cromatide. Microtubulii sunt elemente importante ale cilia și flagelului, cu ajutorul căruia se deplasează celulele.
Cu toate acestea, există un număr mare de proteine care au funcții unice care nu sunt incluse în această clasificare destul de simplă.
6 Proteine de reglementare. denumite adesea hormoni, participă la diferite procese fiziologice.
Proteinele de reglementare includ un grup mare de hormoni proteici implicați în menținerea constanței mediului intern al corpului, care afectează celulele țintă specifice.
Mulți hormoni sunt oligopeptide sau proteine (de exemplu, insulină, glucagon [antagonist al insulinei], hormon adrenocorticotropic etc.).
Insulina hormonală este formată din două # 945; - lanțurile conectate prin punți disulfidice.
Insulina este un hormon format în celulele insulelor Langerhans din pancreas. Acesta joacă un rol crucial în metabolismul glucozei din sânge.
În plus, regulamentul se referă la proteine, a căror atașare la alte proteine sau alte structuri celulare le reglează funcția. De exemplu, proteina de calmodulin într-un complex cu patru ioni de Ca2 + poate fi atașată la unele enzime, schimbându-și activitatea.
Regulatorii proteine de legare a ADN-ului, care se unește la anumite regiuni ale ADN-ului, pot regla viteza citirii informațiilor genetice.
Un hormon care reglează creșterea organismului este sintetizat în glanda pituitară a creierului. Există proteine reglatoare care controlează biosinteza diferitelor enzime din organism.
Figura arată - BELOK INSULIN - sub forma unui model tridimensional și sub forma unei structuri terțiare. Se compune din două # 945 - lanțurile elicoidale conectate prin două punți disulfidice (comparați cu figura 2, unde structura sa este arătată schematic)
INSULIN MOLECULES. construită din 51 de resturi de aminoacizi, fragmente de aminoacizi identici sunt marcate cu o culoare de fundal corespunzătoare. Reziduurile de aminoacizi cisteină conținute în lanț (denumirea prescurtată a TSIS) formează punți disulfidice -S-S-, care leagă două molecule polimerice sau formează punți în același lanț.
Funcția receptorului (semnal) a proteinelor
Moleculele de semnal (hormonii, neurotransmițătorii) acționează asupra proceselor intracelulare prin interacțiunea cu proteine specifice ale receptorilor. Deci, hormonii care circulă în sânge, găsesc celulele țintă și acționează asupra lor, legând în mod specific proteinele receptorilor, de obicei încorporate în membrana celulară. Pentru moleculele de reglaj hidrofobe care trec prin membrana celulară, receptorii sunt localizați în citoplasma celulelor.
Unele proteine încorporate în membrana celulară își pot schimba structura sub influența mediului extern.
Acesta este modul în care semnalele sunt recepționate din exterior și informațiile sunt transferate în celulă.
Un exemplu este fitochromul, o proteină fotosensibilă care reglează reacția fotoperiodică a plantelor, iar opsina este o parte integrantă a rodopsinei pigmentului. o proteină integrată membranară găsită în celulele retinei.
Phytochromul (din culoarea phyto și greacă - vopsea) este un pigment albastru dintr-un grup de proteine complexe - cromoproteine; este prezentă în celulele organismelor fotosintetice. Descoperit inițial de către biochimistul american U. Butler în 1959 în cotiledoane de răsaduri de struguri cultivate în întuneric.
Phytochromurile fluorescente se referă la pigmenți inactivi fotosintetici.
Cu toate acestea, a constatat că sub controlul phytochrome sunt sinteza biopolimer (ADN, ARN, proteine), sistem de clorofilă biosinteză, carotenoide, antociani, fosfați organici, vitamine. F. catabolice accelerează descompunerea polizaharide, lipide și proteine de backup activează respirația celulară și fosforilării oxidative.
Enzimele există în două forme interconvertibile - F660 și F730, diferite în spectrul de absorbție. Sub acțiunea luminii roșii cu lungimea de undă # 955; = 660 nm, F660 inactiv este convertit în F730 activ. Transformarea inversă are loc fie în întuneric, fie sub iluminare cu lumină roșie cu # 955; = 730 nm. Se crede că aceste interconversii se datorează izomerizării cis-trans a cromoforului F. și rearanjamente conformaționale ale proteinei.
Moleculele de semnal (hormoni, neurotransmițători) acționează asupra procesului intracelular prin interacțiunea cu receptorii proteici specifici.
Hormonii care circulă în sânge găsesc celule țintă și acționează asupra lor, legând în mod specific proteinele receptorilor, de obicei încorporate în membrana celulară. Pentru moleculele de reglaj hidrofobe care trec prin membrana celulară, receptorii sunt localizați în citoliză celulară.
Moleculele de semnal (hormonii, neurotransmițătorii) acționează asupra proceselor intracelulare prin interacțiunea cu proteine specifice ale receptorilor. Deci, hormonii care circulă în sânge, găsesc celulele țintă și acționează asupra lor, legând în mod specific proteinele receptorilor, de obicei încorporate în membrana celulară. Pentru moleculele de reglaj hidrofobe care trec prin membrana celulară, receptorii sunt localizați în citoplasma celulelor.
Cele mai importante dintre acestea sunt fitochromii A și B (phyA și phyB). Phytochromul A
efectuează multe funcții fotoregulatoare diferite. Prin participarea sa, stimularea și inhibarea germinării semințelor, inducerea de-etiolării, reglarea sintezei diferitelor enzime, reglarea dezvoltării rădăcinilor, stimularea înfloririi și reglarea ritmurilor circadiene.
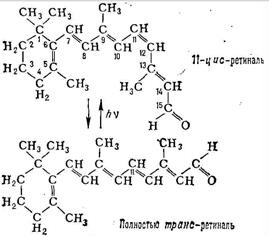
Ciclul schimbărilor majore ale rododinei în tijele retinale
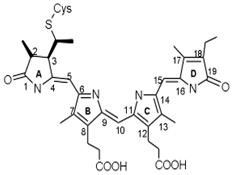
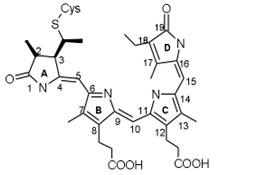
RODOPSIN (din perspectiva rhodonului grecesc - trandafir și opsis - vedere), purpuriu vizual, DOS. pigmentul vizual al tijei retinei vertebrate (cu excepția anumitor pești și amfibieni în stadii incipiente de dezvoltare) și a animalelor nevertebrate.
Potrivit chimicalei. Nature rodopsinei - proteina complex (hromoproteidov), care include 11-cis-retiniene (grupa cromofor), o glicoproteină, o proteină care este unit cu zaharuri și lipide (așa numita side opsina manual ..) ... Piercul. masa vertebratelor de rodopsin aprox. 40 000, cefalopode, aprox. 70 de mii. componenta structurală și funcțională a segmentelor exterioare ale tijelor (vezi. Vision, retina, fotoreceptorii).
act Optic începe R. absorbția fotonilor (absorbție maximă a spectrului R.- aproximativ 500 nm). În acest 11-cis-retiniene la all-trans izomerizare are loc o formă (vezi. Formula), ceea ce conduce la o degradare treptată (fotoliza) MOLECULA schimbare R. în fotoreceptor de ioni de transport electric și aspectul. semnal, care este transmis la elementele nervoase ale retinei. R. Regenerarea este realizată sau prin sinteza opsina 11-cis-retiniene și eliberat pe folotiză sau prin absorbția doilea cuantum al unuia dintre produsele intermediare ale folotiză și, de asemenea, în sinteza de noi discuri segmentului exterior retinal (ultima calea primară pentru stick-uri).
În membranele celulare ale unor bacterii halofile, se găsește un pigment, care include și retina, glicoproteina și lipidele. Această radapșină bacteriană (structura sa nu a fost stabilită în cele din urmă) aparent participă la fotosinteză împreună cu alți pigmenți bacterieni.
De o importanță deosebită pentru acțiunea phytochrome are reversibilitatea ei: această hromoproteidov (proteină complex care conține aminoacizi, în plus, ca componente de colorare), are loc în două forme, poate fi transformat într-unul pe altul.
Phytochrome Albastru 660 (660 F) are un maxim de absorbție în regiunea roșie a spectrului luminos, cu o lungime de undă de 660 nm și albastru-verzui phytochrome 730 (P 730) - într-o regiune a spectrului roșu închis, cu o lungime de undă de 730 nm.
Atunci când este iluminat cu lumină roșie luminoasă, inerția Φ 660 se transformă în f 730 activă fiziologic, iar când luminează cu lumină roșie închisă, are loc conversia lui Ф 730 la Ф 660.
8 Alimente și proteine de rezervă. după cum sugerează și numele, servesc ca surse de nutriție internă, mai des pentru embrioni de plante și animale și, de asemenea, în stadiile incipiente de dezvoltare a organismelor tinere.
Proteinele alimentare includ albumina - principala componenta a proteinei din oua, precum si cazeina - principala proteina a laptelui.
Sub acțiunea enzimei pepsină, cazeina din stomac este obstrucționată, ceea ce îi asigură retenția în tractul digestiv și digestia eficientă. Cazeina conține fragmente de aminoacizi necesari organismului.
În feritină, care este conținută în țesuturile animalelor, se stochează ioni de fier.
Pentru a rezerva proteine includ, de asemenea, mioglobina. în compoziție și structură care amintesc de hemoglobină. Myoglobina este concentrată în principal în mușchi. rolul său principal este depozitarea oxigenului. care îi este dat de hemoglobină. Se saturează rapid cu oxigen (mult mai rapid decât hemoglobina), apoi se transferă treptat către diferite țesuturi, cu efort fizic ulterior și deficit de oxigen pentru al elibera.
Toate aceste varietăți de funcții rezultă dintr-un set foarte simplu de 20 de aminoacizi, din care este construit un lanț polipeptidic de proteine. Diferitele cantități și combinații diferite ale acestor aminoacizi din lanț determină unicitatea unei anumite proteine.
Articole similare
Trimiteți-le prietenilor: