CATALIZĂ (din cataliza grecească - distrugere), schimbarea vitezei chimice. p-tion atunci când sunt expuse la c-c (catalizatori), care sunt implicați în r-tion, dar nu fac parte din produs. Catalizatorul nu este în stoechiometrie. relațiile cu produsele și este regenerat după fiecare ciclu de transformare. reactivi în produse. Distingeți între K pozitiv și negativ, în funcție de faptul dacă catalizatorul accelerează p-tionul sau îl încetinește. Ca regulă, termenul "K." atribuită accelerației p-tionului; in-va, încetinirea p-tion, numit. inhibitori. Katalitich. Efectul asupra p-tiunii poate fi produs de perioada intermediară formată în timpul procesului. Insulele sau în produse (vezi. Autocataliză) .Pentru K. caracteristic faptul că catalizatorul numărului mic accelerează convertit. număr mare de reacții in-in. Astfel, 1 greutate. h. Catalizatorul Pt provoacă o transformare. 10 4 greutate. h. S03 în S02 sau 10% în greutate. h. NH3 în NO. Efectul de accelerare al TION p-ERATOR pe rah p-in-p nu de obicei considerată K., pentru motivul că numărul de p-ERATOR de obicei, depășește în mod semnificativ numărul de reacție a unui dizolvat în. Cu toate acestea, există cazuri cunoscute de accelerare a p-tiunilor în prezență. aditivi foarte mici ai r-ritele, de exemplu. apă. Invarianța chimiei. compoziția și structura catalizatorului la sfârșitul procesului este puțin probabil să servească drept semn obligatoriu al lui K. Se știe că substanța chimică. compoziția catalizatorului evacuat din reactor este substanțial diferită de cea a catalizatorului încărcat; compoziția și structura catalizatorului sunt afectate de compoziția reacției. amestec. Invarianța chimiei. compoziția și structura catalizatorului are sens să fie luată în considerare în raport cu cea a etapelor elementare ale proceselor catalitice complexe. în care participă direct catalizatorul, dar pentru aceasta este necesar să se stabilească în mod fiabil mecanismul p-tion, care nu este întotdeauna posibil. Termenul "K." I. Berzelius introdus în 1835. în cataliză omogenă, catalizatorul și reacționează în insulele sunt în aceeași fază într-o stare de dispersie moleculară. În cazul unei catalizări eterogene, catalizatorul se formează independent. fază, separate de interfață din faza în care sunt substanțele care reacționează. Izolat K. omogenă și heterogenă la rom p-TION începe la catalizatorul solid dressing STI, și continuând apoi în volum. Este obișnuit să se numească cataliză de transfer de fază la limita a două lichide nemiscibile; rolul catalizatorului este transferul reactanților între faze. Split. Poziția dintre K. omogenă și heterogenă ocupă K microheterogenă prin particule coloidale în faza lichidă. Accelerare în prezență. micelă este numit agent tensioactiv. cataliză micelară. Un rol exclusiv în procesele din organismele vii este jucat de cataliza enzimatică, cauzată de acțiunea enzimelor. O componentă importantă a industriei. catalizatorii sunt promotori - in-va, adăugarea cărora la catalizator în număr mic (procente sau fracțiuni procentuale) își mărește activitatea. selectivitate sau stabilitate. Dacă promotorul este adăugat la catalizator în cantități mari sau este el însuși catalitic activ, mixt. In-va, efectul căruia asupra catalizatorului conduce la o scădere a activității sale sau la încetarea completă a activității catalitice. acțiuni, numite. otravurile sunt catalitice. Există cazuri în care același aditiv la catalizator la anumite concentrații și t-rax este un promotor, în timp ce pentru altele - o otravă. În heterog. K. purtători pe scară largă folosiți - in-va, ei înșiși inactivi din punct de vedere catalitic sau inactivi. Aplicarea unui catalizator pe ele crește semnificativ activitatea sa. Ch. arr. datorită creșterii prezenței catalizatorului sau prevenirii particulelor sale de sinterizare (vezi Catalizatorii Aplicați).
Principii generale de cataliză. Toate catalizatorii. p-tions sunt procese auto-derivate, adică, ele curg în direcția pierderii de energie a sistemului Gibbs. Catalizatorul nu schimbă pozițiile de echilibru ale substanței chimice. R-tion, cu excepția influenței sale asupra coeficientului. din activitatea de reacție a c-e în p-ra (sau coeficientul de volatilitate, în cazul p-tions în faza gazoasă la presiuni mari). În apropierea echilibrului, același catalizator accelerează în mod egal pătrunderea înainte și înapoi, departe de echilibru nu poate fi. Din mai multe. Eventualul catalizator r-tions accelerează nu neapărat termodinamic naib. Este avantajos, adică unul pentru care pierderea energiei Gibbs este maximă. De exemplu. în prezența. Bi2O3, propilena MoO3 este parțial oxidat (în acroleină), în prezență. Co3O4, are loc o oxidare completă (până la CO 2 și H 2 O). Măsura selectivității (selectivitatea acțiunii) a catalizatorului este raportul dintre rata de 1/2 O2. MO, 2) MO + H 2. M + H 2 O. Procesele în etapă ale lui K. (denumite și asociative sau fuziune) se desfășoară conform schemei: A + K. AK *. B + K. În acest caz (curba 2 din fig.), Catalizatorul nu formează intervale stabile. Conn. cu reactivi, dar este inclus în activator. complex AK *. P-tionul apare odată cu depășirea unei barieri potențiale care separă stările inițiale și finale ale sistemului, precum și necatalitic. p-tion, dar cu o energie de activare redusă (E4 în Fig.). Catalizator de mare viteză. r-tion m. b. Aceasta nu a provocat doar o reducere a energiei de activare a debitului datorită p-TION a noului mecanism, dar punerea în aplicare a catalizatorului sub acțiunea mecanismului de lanț p-TION. De exemplu. katalitich. efectul vaporilor de apă asupra oxidării în fază gazoasă a CO se explică prin formarea reacțiilor. lanțuri care implică particule active de H și OH. Într-o eterogenă-omogenă. K. pentru particule active formate dressing-ITS (ex. FREE. NO 2 radicali și RO2 în oxidarea hidrocarburilor RH), la- apoi ejectate în faza gazoasă și continuă circuitul.
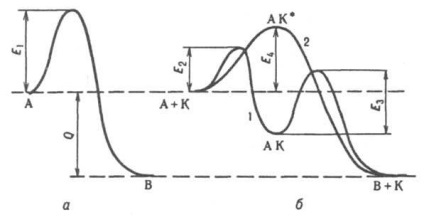
Diagrama energetică a unui tip de reacție A. B; a - fără catalizator, b - cu catalizator K; 1 - sub mecanismul de așezare, 2 - sub mecanismul asociativ de cataliză: E1. E2, E4. E4 bariere potențiale care separă starea inițială și cea finală a sistemului, Q - efectul termic al p-tion.
Sa demonstrat formarea lanțurilor pe suprafața catalizatorului în timpul polimerizării olefinelor și sinteza hidrocarburilor din CO și H2. altul catalitic heterogen. s-au evidențiat caracteristicile caracteristice ale reacțiilor în lanț: generarea de centre active (alternarea locurilor de umplere pe teren și eliberarea acestora), formarea de intervale active. particulele în concentrații de super-echilibru (care contribuie la depășirea barieră a fazelor energetic nefavorabile), ajungând la max. de viteză după o anumită perioadă de timp după înființarea sa. Katalitich. și lanțurile de lanț reunesc și fenomenul cinetic. conjugare. Dacă este convertit. catalizator la nivel reciproc. cu reactivi sunt asociate cu cele mai catalitice. p-TION (m. e. au un intermediar comun. o cantitate sau activat. complex), devine posibil să se formeze un super concentrațiile de echilibru ale siturilor active pe catalizator cosmetizare al. ITS și efectele proceselor lanțului de tipice.
Mecanismele de baza ale catalizei. Katalitich. procese datorate transferului de electroni (oxidare, reducere. hidrogenare, dehidrogenare. descompunerea compușilor instabile de oxigen), se face referire la cataliza ca redox. Catalizatorii tipici pentru ei sunt metalele de tranziție și compușii lor. oxizi simpli (V2 O5 MnO2 MoO 3 Cr2 O 3..), spinel (Fe3 O4 CuCr2 O4.), sulfurile (MoS2 WS2.), etc.; pentru p-tion în sărurile p-rah și soia complexă. metale tranzitorii. Catalizator ridicat. Activitatea acestor substanțe se explică prin faptul că atomii de metale tranziționale pot exista în diferite metale. grade de oxidare, a căror schimbare nu necesită energie mare. costuri. Ca rezultat, transferul electronului din reactiv la catalizator este mai ușor decât în absența unui catalizator de la agentul reducător la oxidant. În tranziția cu un singur electron, se formează un val liber. radicali, apoi participând la ronție. De exemplu. în tranziția unui electron din centrul activ al catalizatorului de molibden la oxigen, se formează un ion radical O2, care participă mai departe în faza catalitică. oxidare (produs Mo 5+ + O 2 Mo 6+ + O 2, O 2 + C n H m). Există o reducere a oxidării. K. cu un mecanism multielectron, la care nu se formează o cădere liberă. radicali ca intermediari. particule. Sunt posibile tranziții cu multe electroni între catalizator și moleculele care reacționează dacă sunt implicate mai multe situsuri active ale catalizatorului. atomi ai unui metal de tranziție. De exemplu. în descompunerea compușilor complexi de H202 sunt activi. conținând 2 ioni de Fe 3+; în restaurarea digului. azot la N2H4 - compuși complexi. conținând 2 sau mai mulți ioni de V2 +. Procesele de cataliză acido-bazică sunt catalitice. cracare. hidratare, deshidratare. pl. izomerizarea p, condensarea org. in-in. Catalizatorii tipici pentru această clasă de procese sunt in-v, capabili să transmită sau să preia un proton din reactivi sau altfel capabili să fie heterolitici. interacțiune. cu reactivi (fără separarea unei perechi de electroni). Printre acestea o-a - proton (H2 SO4 CH3COOH, HF.) Sau aprotic (BF3 AlCl3.) La tine, amorfă și cristalină. alumino-silicați. Al2O 3. Fosfați, sulfați. Centrele active din ele sunt centrul de protoni H + (centrul Brønsted) sau acceptorul perechii de electroni, de exemplu. atomul Al (centrul Lewis). Mai puțin frecvent utilizate sunt catalizatorii caracterului principal (baze dizolvate, CaO solid, MgO, etc.). În cazul așa-numitei. catalizatori multifuncționali, etape individuale de catalizatori complexi. procesele, procesele de oxidare-reducere și acid-bază apar pe diferite componente ale unui sistem multicomponent multifazic. De exemplu. la oxidarea incompletă a aldehidelor nesaturate în prezența substanțelor nesaturate. oxidul Mo și V în actul elementar de oxidare are loc. - Rebuild. catalizatori:
Enciclopedii chimice. - Enciclopedia Sovietică. Ed. I. L. Knunyants. 1988.
Articole similare
Trimiteți-le prietenilor: