1.1. Proprietățile fizice ale apei
Proprietățile fizice sunt pe deplin descrise în multe lucrări. Apa (H2O) este cel mai simplu compus chimic stabil de hidrogen cu oxigen, un lichid incolor cu punct de fierbere de 100 ° C. Formula chimică a apei este atât de simplă: H2O; H-O-H [1-8]. Dimensiunea unei molecule de apă este de aproximativ 3 Å (angstrom) sau aproximativ 0,28 nm (nanometru).
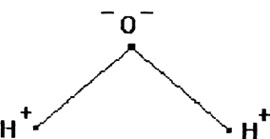
Fig. 1. Diagrama structurii
molecule de apă
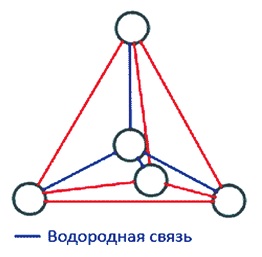
Fig. 2. Structura tetraedrică a moleculei de apă
Apa constă dintr-un atom de oxigen relativ mare și doi atomi de hidrogen mici, în jurul cărora se rotește un nor de electroni încărcați negativ (Figura 1). Unghiul moleculei H-O-H de H2O în formă gazoasă și lichidă variază de la 104,5 până la 109 °
În gheață, toate moleculele sunt legate între ele prin legături de hidrogen. În acest sens, fiecare dintre cele patru molecule aranjate local într-o structură tetraedrică, patru molecule din apropiere sunt aranjate la nodurile unei piramide triunghiulare, un centru de care este a cincea moleculă
apă (figura 2).
Nucleul încărcat pozitiv al atomului de oxigen, datorită masei și încărcării mari, atrage norul de electroni mai puternic la el însuși, în timp ce îndepărtează nucleele de hidrogen.
Trei nuclee din molecula de apă formează un triunghi izoscel cu două protoni de hidrogen în bază și oxigen la vârf. Distanța O-H 0,9568 Å (0,1 nm); H-H - 1,54 Å (0,15 nm). Modelul moleculei de apă propus de Niels Bohr [9] este prezentat în Fig. 3.
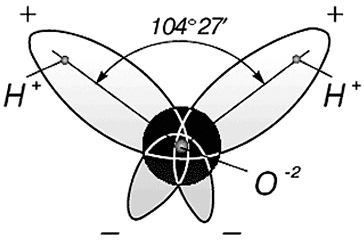
Fig. 3. Structura moleculei de apă, propusă de N. Bohr [9]:
a este unghiul dintre legăturile H-H;
b - apariția norului de electroni al moleculei de apă
Proprietățile apei depind în principal de legăturile de hidrogen. Datorită diferenței mari în electronegativitatea atomilor de hidrogen și oxigen, norii de electroni sunt puternic influențați față de oxigen. Din această cauză, și că ionul de hidrogen nu are straturi de electroni intern și are o dimensiune mică, ea poate pătrunde într-un plic electronic polarizată negativ atom moleculă adiacentă. Datorită acestui fapt, fiecare atom de oxigen este atras de atomii de hidrogen ai altor molecule și invers.
Fiecare moleculă de apă poate participa la maximum patru legături de hidrogen: doi atomi de hidrogen - unul în fiecare și unul din doi atomi de oxigen; în această stare moleculele sunt într-un cristal de gheață. Odată cu topirea gheții, unele dintre legături se rup, ceea ce face posibilă așezarea moleculelor de apă mai dens; când apa este încălzită, legăturile continuă să se rupă și densitatea acesteia crește, dar la temperaturi de peste 4 ° C acest efect devine mai slab. Când evaporarea întrerupe toate legăturile rămase. Ruperea legăturilor necesită o mulțime de energie, de aici temperatură ridicată și specifică
căldura de topire și fierbere și capacitatea mare de căldură. Viscozitatea apei se datorează faptului că legăturile de hidrogen împiedică mișcările de apă să se deplaseze la rate diferite. Structura norului de electroni de molecule de apă astfel încât gheața fiecare moleculă este legată de patru legături de hidrogen cu moleculele din apropiere acestea, numărul de molecule de coordonare în structura de gheață este de patru. Mărimea moleculei poate fi judecată din distanța dintre cele mai apropiate molecule din gheață, care este de 2,67 Å (0,267 nm). În mod corespunzător, o moleculă de apă poate fi atribuită o rază de 1,38 Å (0,138 nm). Momentul dipol al apei este 1,87 Debye. dipol electric moment, - vector cantitate fizică ce caracterizează, împreună cu o încărcătură totală a proprietăților electrice ale sistemului de particule încărcate (distribuție de încărcare) în sensul că produce câmpul și acțiune pe ea câmpurilor externe.
Studiile au arătat că apa păstrează ordinea cu rază scurtă de timp inerentă structurii gheții. În consecință, tendința fiecărei molecule de apă de a înconjura cele patru molecule cele mai apropiate și de a forma legături de hidrogen cu ele este inerent atât în stările lichide, cât și în cele solide. Distanța dintre cele mai apropiate molecule în timpul topirii gheții variază de la 2,76 Å (0,276 nm) până la 2,90 Å (0,29 nm). Poziția intrinsecă a moleculelor cele mai apropiate conduce la o structură foarte slabă și delicată. Acesta este motivul pentru proprietatile anormale ale apei.
Aproape molecula sferică de apă are o polaritate pronunțată, deoarece încărcăturile electrice în ea sunt asimetrice. Fiecare moleculă este un dipol miniatural cu un moment mare de dipol.
Polaritatea moleculelor, prezența în ele a sarcinilor electrice parțial necompensate creează grupuri de molecule - asociați. Complet corespunde numai formulei de apă H2O, care este în stare de vapori. În intervalul de temperaturi de la 0 la 100 ° C, concentrația de molecule individuale (molecule monomere) de apă lichidă nu depășește 1%. Toate celelalte molecule de apă sunt combinate în asociați cu diferite grade de complexitate, iar compoziția lor este descrisă de formula generală
[H2O] X. Motivul pentru formarea asociaților este legăturile de hidrogen. Ele apar între nucleele de hidrogen ale unor molecule și "condensările" electronice ale nucleelor de oxigen ale altor molecule de apă.
Distribuția neuniformă a sarcinilor electrice conduce la faptul că molecula de apă este polarizată, devine un magnet mic.
Într-un câmp magnetic al Pământului, moleculele de apă în stare lichidă sunt asamblate în unele structuri instabile sub influența atragerii poliilor încărcați eterogen. Instabilitatea unor astfel de structuri este determinată de slăbiciunea legăturilor de hidrogen dintre moleculele de apă, uneori numite poduri de hidrogen.
Forma tetraedrică a unei molecule individuale este repetată în structura cristalină a gheții. Eventual joacă un rol aici este faptul că unghiul molecula H-O-H este H2O aproape ideal unghi tetraedrică 109 °, iar moleculele de apă, după cum știm, sunt combinate prin intermediul unor legături de hidrogen, care sunt formate exact în direcția O-H. Aceste piramide triunghiulare pot fi de asemenea combinate într-o anumită suprastructură. În gheață, o suprastructură tridimensională complexă de tetraedru se extinde pe întregul volum (figura 4).
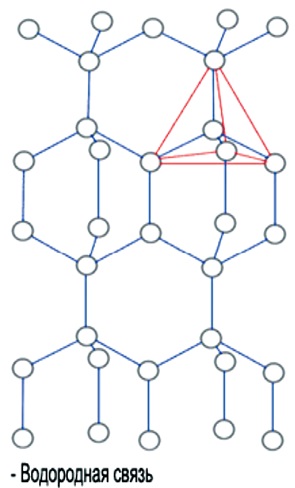
Fig. 4. Structura H2O a gheții
Molecula de apă ca gheața conține atât molecule simple de apă, cât și un grup de structuri asemănătoare gheții (Figura 5).
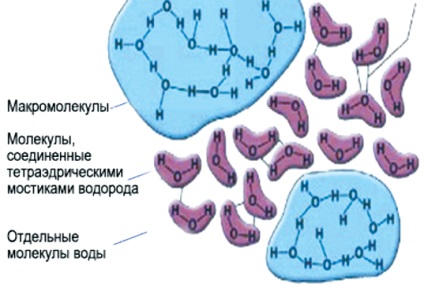
Fig. 5. Structura apei de gheață
Articole similare
-
Instrucțiunea "de autorizare pe site-ul prin dgtu kiosk electronic" selectați site-ul "de învățământ
-
Folosim un dyadok pentru a face schimb de documente electronice! PNO
Trimiteți-le prietenilor: