1. Atomul este o particulă complexă. Starea electronilor vatomului.
1.1 Atomul este o particulă complexă.
Atomul este un sistem neutru electric de interacțiune a particulelor elementare, constând dintr-un nucleu (format din protoni și neutroni) și electroni.
Electronii, protonii și neutronii se numesc particule elementare. Care sunt proprietățile acestor particule?
Corpuscular-val proprietăți ale microworld. Particulele elementare și sunt construite din nuclee atomice, atomi și molecule au o greutate și dimensiuni neglijabile și, prin urmare, au proprietăți particulare ale acestora nu sunt similare cu cele care au obiecte macrocosmosul în jurul nostru. Ei își formează propria lor lume specifică - microcosmosul. care trăiește prin legi speciale dictate de mecanica cuantică - știința structurii și proprietăților particulelor elementare, nucleelor, atomilor și moleculelor.
Mecanica cuantică caracterizează particulele microproceselor ca obiecte cu dublă natură - dualismul valurilor corpusulare. ele sunt particule (corpusculi) și valuri.
Electronul este o particulă care determină proprietățile chimice cele mai caracteristice ale atomilor și moleculelor. Natura dublă a unui electron poate fi confirmată experimental. Dacă electronii emise de o sursă, de exemplu un catod, trec prin găuri mici într-o placă așezată în calea lor, atunci când ajung la placa fotografică, o fac să se înnegrească. După manifestarea plăcii fotografice pe ea, se poate vedea un set de inele de lumină alternantă și întunecate, adică un model de difracție (figura 1).
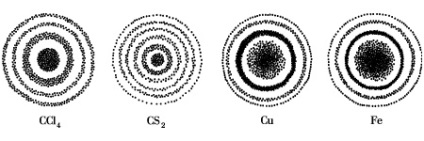
Electronograme de gaze (stânga) și cristale (dreapta).
Punctul central se datorează unui fascicul de electroni nescutit,
iar inelele sunt electroni împrăștiați la unghiuri diferite
Modelul de difracție include atât difracția reală - plicul de undă al obstacolului, cât și interferența. adică impunerea de valuri unul pe celălalt. Aceste fenomene demonstrează prezența proprietăților undelor într-un electron, deoarece numai valurile sunt capabile să înfrunte obstacolele și să se suprapună unul pe altul în locurile unde se întâlnesc. Cu toate acestea, ajungând la stratul de filmare, electronul dă înnegrirea numai într-un singur loc, ceea ce indică faptul că are proprietăți particulare. Dacă ar fi fost doar o undă, ar fi luminat mai mult sau mai puțin uniform întreaga placă.
1.2 Starea electronilor într-un atom
Electronul din atom nu are nici o traiectorie de mișcare, adică se poate vorbi doar despre probabilitatea de a fi găsit în spațiul din jurul nucleului. Poate fi în orice parte a acestui spațiu care înconjoară nucleul, iar totalitatea pozițiilor sale diferite este tratată ca un nor de electroni cu o anumită densitate de încărcare negativă.
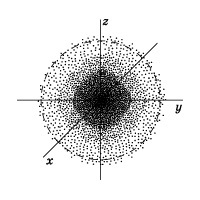
Figura 2 prezintă o "tăiere" a unei astfel de densități electronice într-un atom de hidrogen care trece prin nucleu, iar linia punctată este legată de o sferă, în cadrul căreia probabilitatea de detectare a unui electron este de 90%. Conturul cel mai apropiat de nucleu cuprinde o regiune a spațiului în care probabilitatea de a detecta un electron
10%, probabilitatea de a detecta un electron în interiorul celui de-al doilea din nucleul circuitului este
20%, în interiorul celui de-al treilea -
Regiunea de probabilitate pentru detectarea unui electron nu are limite clare. Cu toate acestea, este posibil să se identifice un spațiu în care probabilitatea de a găsi un electron este maximă.
Spațiul din jurul nucleului atomic, în care este cel mai probabil să se găsească electronul, se numește orbital.
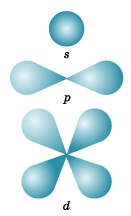
Conține aproximativ 90% din norul de electroni, ceea ce înseamnă că aproximativ 90% din timp este în această parte a spațiului. Conform formularului, se disting patru tipuri cunoscute de orbite, care sunt notate cu literele latine s. p. d și f. O reprezentare grafică a unor forme de orbite electronice este prezentată în figura 3.
Cea mai importantă caracteristică a mișcării unui electron pe o anumită orbitală este energia ei de legătură cu nucleul.
Electronii cu valori energetice similare formează un singur strat electronic sau nivel de energie. Nivelurile de energie sunt numerotate pornind de la nucleu: 1, 2, 3, 4, 5, 6 și 7.
Integerul n. care indică numărul de nivel energetic, se numește numărul cuantumului principal.
Numărul de niveluri de energie (coji de electroni) într-un atom este egal cu numărul perioadei în sistemul de Mendeleev, care aparține unui element chimic: atomii elementelor primei perioade - un nivel de energie de a doua perioade - două șaptea perioadă - șapte.
Cel mai mare număr de electroni la nivelul energiei este determinat de formula
unde N este numărul maxim de electroni; n este numărul de nivel sau numărul cuantic principal. În consecință, la primul nivel de energie cel mai apropiat de nucleu nu pot exista mai mult de doi electroni;
pe al doilea - nu mai mult de 8;
pe al treilea, nu mai mult de 18;
pe al patrulea - nu mai mult de 32.
Si cum, la rândul lor, aranjate în nivelurile de energie (straturi de electroni)? Pornind de la al doilea nivel de energie (n = 2), fiecare dintre straturi este subdivizat în subnivele (substraturile), ușor diferit unul de altul datorită energiei nucleului.
Numărul subsolurilor este egal cu valoarea numărului principal cuantum. primul nivel de energie are un subsol; a doua - două; al treilea - trei; a patra - patru subsoluri. Sublevelle, la rândul lor, sunt formate din orbite. Subalvelurile sunt de obicei marcate cu litere latine, precum și forma orbitalilor din care sunt compuse: s. p. d. f.
s-Sublevel - primul subsol al fiecărui nivel de energie cel mai apropiat de nucleul unui atom, constă într-o s-orbită;
p-subblevel - al doilea subsol al fiecăruia, cu excepția primului nivel de energie, constă din trei p-orbitale;
d-sublevel - cea de-a treia subsol a fiecăruia, începând cu al treilea nivel de energie, constă din cinci d-orbitali;
Substratul fiecăruia, începând cu cel de-al patrulea nivel de energie, constă în șapte f-orbitale.
2. Configurări electronice ale atomilor de elemente chimice
fizicianul elvețian Wolfgang Pauli în 1925 a constatat că în atom, pe de o orbital poate fi nu mai mult de doi electroni cu opuse (antiparalel) spate (în limba engleză „ax“) Acest principiu este cunoscut sub numele de principiul de excluziune al lui Pauli.
Dacă pe orbital există un electron, acesta se numește nepereche. dacă doi, atunci e electroni perechi. adică electroni cu rotiri opuse
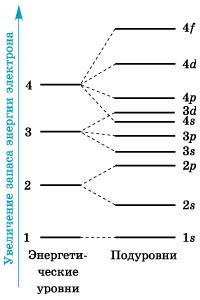
Schema de subdiviziune a nivelurilor de energie în subsoluri
Figura 1 prezintă o diagramă a subdiviziunii nivelurilor de energie în subsoluri.
s-orbital. după cum știți deja, are o formă sferică.
Electronul atomului de hidrogen (n = 1) este situat pe această orbitală și nu este cuplat. Prin urmare, este o formulă electronică sau configurația electronică va fi scris ca: 1s 1. Nivelul de energie de electroni formule desemnate număr de cifre înainte de litera (1), literele latine reprezintă sub-strat (orbitali de tip), iar numărul care este scris pe partea din dreapta sus a literei ( ca exponent), arată numărul de electroni de la subsol.
Pentru atomul de heliu He, care are doi electroni perechi pe o s-orbită, această formulă: 1s 2.
Coaja de electroni a atomului de heliu este completă și foarte stabilă. Heliul este un gaz nobil.
La al doilea nivel de energie (n = 2) există patru orbitali: unul s și trei p. Electronii s-orbitali ai celui de-al doilea nivel (2s-orbitale) au o energie mai mare, deoarece sunt la o distanță mai mare de nucleu decât electronii 1s-orbitalului (n = 2)
P-orbitalul are forma unei gantere sau a unei figuri voluminoase. Toate cele trei orbite p sunt localizate în atomul reciproc perpendicular de-a lungul coordonatelor spațiale trase prin nucleul atomului. Trebuie subliniat încă o dată că fiecare nivel de energie (stratul electronic), începând cu n = 2, are trei p-orbitale. Pe măsură ce valoarea n crește, electronii ocupă p-orbitale localizate la distanțe mari de la nucleu și direcționate de-a lungul axelor x, y, z.
Pentru elementele celei de-a doua perioade (n = 2), primul s-orbital este umplut mai întâi și apoi trei p-orbitale. Formula electronică este Li. 1s 2 2s 1 2s 1. electronic mai slab asociat cu nucleul atomic, deci atom de litiu se poate da cu ușurință (cum vă amintiți, acest proces este numit oxidare), transformându-se în ioni de Li +.
In atom de beriliu Be0 patrulea electron este de asemenea situat pe 2s orbitale: 1s 2s 2 2. Doi electroni extern atom de beriliu ușor detașat - Ve0 este oxidat în kationVe2 +.
La atomul de bor cincea 2p electron orbital ocupă: 1s 2s 2 2 2p atomi 1. Mai departe, la C. N. O. F este umplută 2p orbitali, care se termină la un neon gaz nobil: 1s 2s 2 2 2p 6.
Elementele celei de-a treia perioade sunt pline cu orbite 3s și 3p, respectiv. Cinci d-orbitali ai celui de-al treilea nivel rămân liber în același timp:
Uneori, o diagramă ilustrând distribuția electronilor în atomi, indică doar numărul de electroni la fiecare nivel de energie, adică este scris atomii electronice formula abreviat de elemente chimice, în contrast cu formulele electronice totale de mai sus, de exemplu: 11Na 2, 8, 1; 17CI2, 8, 7; 18Ar 2, 8, 8.
Pentru elementele de mari perioade (al patrulea și al cincilea), primii doi electroni ocupă orbitele 4s și respectiv 5s: 19K 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Deoarece al treilea element pentru fiecare perioadă majoră, următorii zece electroni merge la 3d anterioare - și 4d orbital respectiv (y elemente laterale ale subgrupe): 23V 2, 8, 11, 2; 26Fe 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Tr 2, 8, 18, 13, 2. In general, atunci când -poduroven d anterioară este umplut, începe să se umple cu un extern (respectiv 4R- 5R-) p -poduroven: 33As 2, 8, 18, 5; 52Te 2, 8, 18, 18, 6.
Elemente lungi perioade - a șasea și a șaptea neterminat - subnivele electronice și niveluri sunt umplute cu electroni este în general după cum urmează: primii doi electroni merge la -poduroven extern s: 56Va 2, 8, 18, 18, 8, 2; 87Fr 2, 8, 18, 32, 18, 8, 1; următor un electron (y La și Ac) la -poduroven d precedent: 57La 2, 8, 18, 18, 9, 2 și 89As 2,8,18, 32, 18, 9, 2.
Apoi, următorii 14 electroni vor merge la a treia în afara nivelului de energie prin orificiile 4f și 5f respectiv în lantanide și actinide:
Apoi se va începe din nou crearea celui de-al doilea nivel de energie externă (d-substrat): pentru elementele subgrupurilor secundare: 73Ta 2, 8, 18, 32, 11, 2; 104Rf 2, 8, 18, 32, 32, 10, 2, - și, în cele din urmă, numai după umplerea completă a substratului d de zece electroni se va umple din nou substratul p extern:
Foarte des, structura cochilii de electroni de atomi este reprezentat de celulele energetice sau cuantice - scrie așa-numita formulă grafică electronică. Pentru această înregistrare se utilizează următoarea notație: fiecare celulă cuantică este notată cu o celulă care corespunde unei singure orbite; fiecare electron este notat cu o săgeată corespunzătoare direcției de rotație. Când scrieți o formulă electronică grafică, trebuie amintite două reguli: principiul Pauli. în care celula (orbital) poate fi nu mai mult de doi electroni, dar cu spini antiparalele și regula F. Hund. conform căreia electronii ocupă celule libere (Orbitali) sunt aranjate în ele mai întâi de către unul și, astfel, au aceeași valoare a spinului, și numai apoi sunt împerecheate, dar partea din spate în timp ce la principiul de excluziune să fie deja invers direcționate.
În concluzie, considerăm din nou cartografierea configurațiilor electronice ale atomilor elementelor primei și celei de-a doua perioade ale sistemului DI Mendeleyev.
Elemente din prima perioadă
Documente conexe:
konspeleklektiy la curs "Chimie de suprafață" Conf. univ. Vasilevskaya E.I. Curs 1 Idei generale despre suprafața solidelor Istoria formării chimiei. Dimensiunea fractală corespunde suprafeței fractale. o serie de cerințe. este de ordinul lui.
OF CONCEPTS ON. clasele generale de schimbare a dispozitivului, în conformitate cu cerințele moderne ale profesorului, atât în ceea ce privește învățământul, cât și pe. ; în chimie pirotehnică. lucrări de laborator și pulberi. Pregătirile sunt compilate în armata corespunzătoare.
.... Konspektlektsiypo disciplina: „Metode de investigare a parametrilor structurilor semiconductoare dezordonate“ (8 prelegeri cerințe de acoperire, chimia polimerilor, și în general radiația corespunde = polarizare circulară și polarizator și forma (0,5 - 1) ..
Konspektlektsiypo. prin parametrii electrofizici FS sunt una dintre cele mai importante cerințe tehnologice. cm2, determinată în conformitate cu formula (8). chimie de suprafață. sunt numite. În general, grosimea zonei de reacție este.
Articole similare
Trimiteți-le prietenilor: