2. Compus binar nemetalic și nemetalic.
In majoritatea nemetalelor reacționează cu alte nemetale atunci când este încălzit, formând compuși binari (non-metal cu acte electronegativitate inferioare ca un agent de reducere, cu atât mai mare - ca oxidant). Excepțiile sunt reacțiile dintre halogeni (cu excepția F2) și oxigen, astfel încât oxizii de halogen sunt produsi indirect. F2. ca cel mai activ nemetalic, în condiții normale reacționează cu toate nemetalele (cu H2 cu explozie).
3. Metal (în serie de solicitări la Al) + H2O = hidroxid + H2.
Metal (în serie de tensiuni de la Mn la H2) + H2O3 + H2.
Metal (în serie de solicitări după H2) + H2O (fără reacție).
Metale permanente în seria electrochimică de Al, inclusiv, reacționează cu apă în condiții normale, formând un hidroxid de metal și hidrogen (Mg reacționează atunci când este încălzit, Al -. La demontarea filmului dens AI2 O3 oxid Be nu reacționează cu apa). De exemplu:
2K + 2H2O = 2KOH + H2.
Metalele care stau într-o serie de tensiuni de la Al la H2. reacționează cu abur supraîncălzit pentru a forma hidrogen și oxid de metal:
3Fe + 4H2O = Fe3O4 + 4H2, 2Cr + 3H2O = Cr203 + 3H2.
Metalele care se află în seria de tensiuni după H2. cu apă nu interacționează:
Cu + H2O (fără reacție).
4. Non-metal + apă.
În condiții obișnuite, numai F2 interacționează cu apa. În acest caz se formează un amestec complex de substanțe. oxigenul atomic eliberat are o activitate chimică ridicată:
Parțial cu apă, interacționează cu Cl2 și Br2. Cu toate acestea, balanța acestor reacții este puternic părtinitoare la stânga:
Cl2 + H2O HCI + HCIO, Br2 + H2O HBr + HBrO.
Uneori aceste reacții sunt neglijate, având în vedere că se ocupă cu soluții de Cl2 și Br2 în apă - cu apă clor și brom.
La temperaturi ridicate, unele nemetale reacționează cu vaporii de apă:
C + H2O = CO + H2, Si + 2H2O = Si02 + 2H2.
Interacțiunea dintre metale și nemetale cu alți compuși va fi studiată ulterior.
PROSPECT S ebb
Exercitarea 1. Marcați rezultatele interacțiunii apei cu metalele cu săgeți.
Exercițiul 2. Finalizați ecuațiile de reacție:
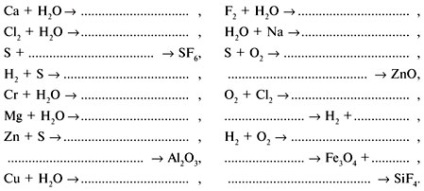
Exercitarea 3. Determinați ce elemente sunt implicate:
a) element A - lichid la nu metal. ;
b) N-metalul B formează nisip atunci când interacționează cu vaporii de apă. ;
c) elementul B formează două substanțe simple gazoase. ;
d) elementul F formează cel mai ușor gazos la n. y. substanță simplă. ;
e) elementul de oxid D - cel mai răspândit pe Pământ.
Exercițiul 4. Compilați ecuațiile de reacție conform schemelor (într-un notebook separat):
a) cu H2NaHH2H2OKOH;
b) Cl2HCIH2H2O HCI;
c) N2Ca3N2NH3.
Exercițiul 5. În conformitate cu schemele de reacție, substanțele A, B și C sunt definite (A și B sunt simple, adică ele constau din atomii unui element):
A + B H2O, B + Cl2C.
7.1. Clasificarea oxidului
Oxizii sunt compuși ai atomilor de două elemente, dintre care unul este oxigenul în starea de oxidare -2.
În oxizi, atomii de oxigen sunt asociați doar cu atomii celuilalt element și nu sunt legați între ei. Compușii care conțin în compoziția lor legați direct unul de celălalt atomi de oxigen (-O-O-) sunt numiți peroxizi.
Nu formați doar oxizi ai lui He, Ne, Ar și F. Se disting oxizii mai înalți. în care atomul elementului prezintă un grad mai mare de oxidare (de obicei egal cu numărul grupului în care este localizat elementul) și oxizii inferiori sunt cei în care atomul de element prezintă o stare de oxidare mai scăzută. Oxizii care conțin atomi de element în diferite grade de oxidare se numesc dublu, de exemplu:
Fe3O4FeO • Fe2O3. Mn3O4MnO • Mn2O3. Pb2O3PbO • PbO2.
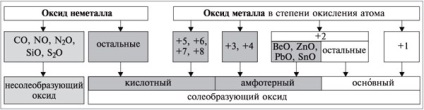
Prin proprietățile chimice de oxizi sunt împărțite în formatoare de sare (săruri de formă, atunci când reacționează cu acizi și / sau baze) și nesoleobrazuyuschie (nu formează săruri, sunt indiferenți față de acizi și baze, și includ CO, NO, N2 O, SiO, S2 O).
Mulți oxizi care formează sare adaugă apă. Acest proces se numește hidratare, iar produsele sale sunt oxizi hidrați sau hidroxizi (conțin una sau mai multe grupări hidroxi -OH).
Unii oxizi cu apă nu interacționează, hidroxizii lor pot fi obținuți indirect.
Oxidul și hidroxidul corespund unul cu celălalt dacă conțin unul și același element cu același grad de oxidare a atomului.
Oxizii de formare a sărurilor sunt împărțiți în bazic, acid și amfoteric, în funcție de tipul de hidroxid corespunzător. Proprietățile bazice acide ale oxizilor și hidroxidurilor înrudite (Na2O și NaOH, S03 și H2S04) coincid.
Principalii sunt oxizii, care corespund bazelor de hidroxizi.
Acidul se referă la oxizii la care corespund acizii hidroxizi.
Amfoterice sunt numite oxizi, care corespund hidroxidurilor amfoterice.
Nemetalele formează doar oxizi acide și care nu formează sare; metalele formează toți oxizii de bază, toți amfoterici și unii oxizi acide. Multe metale din subgrupele secundare care au un compus variabil în compuși. atomi, pot forma mai mulți oxizi și hidroxizi, natura cărora depinde de s.o. atom al elementului. Pe măsură ce gradul de oxidare al elementului crește, electronegativitatea crește. În consecință, proprietățile nemetalice ale elementului cresc, precum și proprietățile acide ale oxidului și hidroxidului său.
Oxizi de metale în s.o. atomii +1 (Na2O, K2O, etc.), precum și majoritatea oxizilor metalici din soia. atomii +2 (FeO, MgO, etc.) sunt bazici. Excepții: BeO, ZnO, PbO, SnO - amfoteric. Majoritatea oxizilor metalici în s.o. atomii +3 și +4 sunt amfoți (Al2O3, Cr2O3, Fe2O3, SnO2, PbO2, etc.). Oxizi de metale în s.o. atomi +5, +6, +7, +8 - acid (Mn2O7, CrO3, Sb2O5, etc.) (Schema 1).
PROSPECT S ebb
1. Exercise selectați oxizii de formula, denumirea și compoziția lor formulele lor grafice (oxizi în numărul de conexiuni egal cu atomii membri SD E-O, legături O-O, nu sunt prezente):
Exercițiul 2. Desenați formule grafice de substanțe:
bioxidul de carbon, monoxidul de carbon, gazul de gaze, cenușă neagră, alumină, magneziu ars, silice, dioxid de sulf.
Exercițiul 3. Fără a se referi la sistemul periodic (PS), determinați ce grup conține elementele chimice care formează oxizii mai mari:
Exercitarea Formula 4. Asigurați-oxizi ai elementelor superioare ale numerelor atomice 14, 34, 41, 75, 33, 50, 40, le numim și să identifice natura lor (de bază, acid, amfoteri, nesoleobrazuyuschy).
Exercitarea 5. Desenați formule grafice și indicați natura oxizilor:
a) azot cu grade de oxidare a atomilor +1, +2, +3, +5;
b) clor cu grade de oxidare a atomilor +1, +3, +5, +7;
c) mangan cu grade de oxidare a atomului +2, +3, +4, +7.
Exercițiul 6. Formulați formulele și indicați natura oxizilor mai mari ai tuturor elementelor: a) VIa grupului PS; b) a treia perioadă a SS. Care este regularitatea în schimbarea proprietăților oxizilor mai mari ai elementelor din aceeași perioadă?
Exercitarea 7. Definiti elementele prin urmatoarele date:
a) elementul celei de-a treia perioade, cel mai mare oxid fiind O2O5. ......................... ;
b) element al celei de-a doua perioade, cel mai mare oxid - EO2. ......................... ;
c) elementul V al grupului PS, formează un oxid superior în care numărul total de protoni dintr-o moleculă este mai mic de 80 și numărul total de electroni este mai mare de 55, ................ ;
d) elementul X formează doi compuși binari cu oxigen, dintre care nici unul nu este un oxid, ................ ;
e) elementul Y formează două oxizi gazoși (s2 sunt egali cu +2 și +4), unul dintre aceștia fiind unul care nu formează sare ................ ;
e) elementul Z sub forma unei substanțe simple face parte din atmosfera terestră, formează două oxizi care nu formează sare și câteva substanțe care formează săruri ................
Exercițiul 8. Folosind surse din literatură, se determină starea agregată, culoarea și volatilitatea următoarelor oxizi:
7.2. Oxizi și hidroxizii lor corespunzători
Programul de activitate nr. 4
"Prepararea formulei de oxid corespunzătoare hidroxidului"
exemple de rezolvare a problemelor în chimia generală. Chimie anorganică. Chimie organică. În general, acoperă toate subiectele. (Formula Produse chimice structurale stepenokisleniya clase de substanțe anorganice, desen formule chimice. Oxizii.
Curriculum de lucru
formule, grad de oxidare Teste în chimie Surovtseva RP Guzei LS. Popova OA Testarea lucrărilor de chimie anorganică N.P. Gavruseyko.
electronegativitate, valență, grad de oxidare; teoriile de bază ale chimiei. structura compușilor organici. Nemetale. Acide anorganice și organice. Bazele sunt anorganice și organice. Anorganică și organică amfoterică.
Curriculum de lucru
Trimiteți-le prietenilor: