Interacțiunea intermoleculară. interacțiunea dintre moleculele sau atomii neutri din punct de vedere electric; determină existența lichidelor și a cristalelor moleculare. Diferența dintre gazele reale și gazele ideale se manifestă printr-o varietate de fenomene fizice. interacțiune intermoleculară depinde de distanța r dintre moleculele și de obicei descrie energia potențială interacțiune U (r) (potențială interacțiune intermoleculară), deoarece este energia potențială medie de interacțiune determină starea și proprietățile multor substanțe.
Prima interacțiune intermoleculară a fost luată în considerare de J. van der Waals (1873) pentru a explica proprietățile gazelor și lichidelor reale. Van der Waals a sugerat că la distanțe mici r, forțele de repulsie acționează între molecule, care, cu o distanță în creștere, sunt înlocuite de forțe atractive. Pe baza acestor concepte, fără a lua în considerare chiar dependența cantitativă a interacțiunii intermoleculare pe distanță, el a obținut așa-numita ecuație van der Waals a stării unui gaz real.
Interacțiunea intermoleculară este de natură electrică și constă în forțe atractive (orientare, inducție și dispersie) și forțe respingătoare.
Forțele orientale acționează între moleculele polare. care este, posedând momente electrice dipol (a se vedea dipolul electric). Forța atractivă dintre două molecule polare este maximă în cazul în care momentele lor dipol sunt situate de-a lungul unei linii (figura 1). Această forță se datorează faptului că distanța dintre diferitele încărcări este puțin mai mică decât între aceleași. Ca urmare, atracția dipolilor depășește repulsia lor. Interacțiunea dintre dipoli depinde de orientarea lor reciprocă și, prin urmare, forțele interacțiunii dipol sunt numite orientare. Căderea mișcărilor termice haotice modifică în mod continuu orientarea moleculelor polare. dar, după cum arată calculul, media pentru toate orientările posibile, valoarea forței are o anumită valoare care nu este egală cu zero. Energia potențială a interacțiunii orientale intermoleculare Uop (r)
r -7. Forța Fore scade cu o distanță mult mai rapidă decât forța de interacțiune a corpurilor încărcate de Coulomb (Fcul
Forțele inductive (sau polarizarea) acționează între molecule polar și nepolar. O moleculă polară creează un câmp electric care polarizează o moleculă cu încărcături electrice distribuite uniform pe întregul volum. Încărcăturile pozitive sunt deplasate în direcția câmpului electric și negative - împotriva. Ca urmare, o moleculă nepolară induce un moment dipol.
p1 a 2 / r 6. Această energie se numește inducție, deoarece apare datorită polarizării moleculelor. indusă prin inducție electrostatică. Forțele de inducție (Găsiți
Între moleculele nepolare, acționează interacțiunea intermoleculară a dispersiei. Natura acestei interacțiuni a fost clarificată complet numai după crearea mecanicii cuantice. În atomi și molecule, electronii se mișcă într-o manieră complexă în jurul nucleelor. Pe parcursul timpului, momentele dipol ale moleculelor nepolare se dovedesc a fi zero. Dar, în orice moment, electronii ocupă o anumită poziție. Prin urmare, valoarea instantanee a momentului dipolului (de exemplu, pentru un atom de hidrogen) este diferită de zero. Un dipol instantaneu creează un câmp electric care polarizează molecule adiacente. Ca urmare, apare interacțiunea dipolilor instantanee. Energia interacțiunii dintre moleculele nepolare este rezultatul mediu al interacțiunii tuturor dipolilor instant posibili cu momentele dipolului. pe care le induc în moleculele vecine datorită inducției. Energia potențială a interacțiunii intermoleculare a dispersiei Udisp (r)
r-7 (aici a 1 și 2 sunt polarizabilitățile moleculelor care interacționează). Interacțiunea intermoleculară a unui tip dat se numește dispersie, deoarece dispersia luminii în materie este determinată de aceleași proprietăți ale moleculelor. ca această interacțiune. Forțele dispersante acționează între toți atomii și moleculele. deoarece mecanismul apariției lor nu depinde de faptul dacă moleculele (atomii) au momente dipol constante sau nu. De obicei, aceste forțe depășesc atât orientarea, cât și inducția. Numai în interacțiunea moleculelor cu momente mari de dipol. de exemplu molecule de apă. Fore> Pdisp (de 3 ori pentru moleculele de apă). Cu interacțiunea acestor molecule polar. ca CO, HI, HBr și alții, forțele de dispersie sunt zeci și sute de ori mai mari decât toate celelalte. Este foarte important ca toate cele trei tipuri de interacțiuni intermoleculare să scadă în același mod cu distanța:
Forțele repulsive acționează între molecule la distanțe foarte mici atunci când învelișurile de electroni pline de atomi intră în contact. care fac parte din molecule. Principiul existent în mecanica cuantică a lui Pauli interzice penetrarea învelișurilor de electroni pline unul în celălalt. Forțele repulsive care rezultă depind într-o măsură mai mare decât forțele de atracție, individualitatea moleculelor. Pentru un acord bun cu datele experimentale se presupune că energia potențială a forțelor repulsive Uot crește cu distanța descendentă în conformitate cu legea Uot (r)
Dacă presupunem că U (r) = 0 pentru r ¥ .. și să ia în considerare faptul că energia de atracție scade cu o distanță descrescătoare proporțională cu r -6. iar energia repulsivă crește ca r-12. atunci curba U (r) va avea forma prezentată în Fig. 2. Minimul energiei potențiale corespunde distanței la care forțele de interacțiune ale moleculelor sunt zero.
Pentru a calcula cu suficientă precizie, U (r) pe baza mecanicii cuantice cu o mare varietate de perechi de molecule interacționate este practic imposibilă. Nu este posibil să măsuram experimental puterea interacțiunii la distanțe intermoleculare. Prin urmare, este obișnuit să selectăm o astfel de formulă pentru U (r), astfel încât calculele realizate cu aceasta să poată fi bine coordonate cu experimentul. Formula cea mai frecvent utilizată
așa-numitul potențial Lennard-Jones. In formula valorile e și sunt determinate experimental pe baza dependenței proprietăților substanțelor (de exemplu, coeficienții de difuzie. Conducția sau viscozitate) a S și E.
Lit. Radcenko IV Fizica moleculară, M. 1965; Coulson K. Forțele interatomice - de la Maxwell la Schrodinger, "Uspekhi Fizicheskikh Nauk", 1963, v. 81, c. 3; Hirschfelder J. Curtiss C. Byrd R. Teoria moleculară a gazelor și a lichidelor. traducere din engleză, M. 1961.
Fig. 1. Două dipol electric ab și cd în poziția reciprocă sunt atrase, t. K. tarifele oppositely la punctele b și să interacționeze cu mai mult decât aceleași acuzații la punctele a și c (precum și b și d).
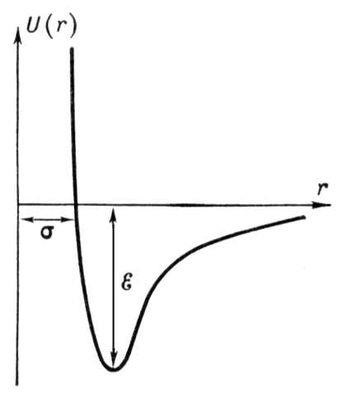
Fig. 2. Dependența potențialului U (r) al interacțiunii intermoleculare Lennard-Jones la distanța r între molecule. Distanța r = s este cea mai mică distanță posibilă dintre moleculele fixate. e este adâncimea "puțului potențial" (energia de legare a moleculelor).

Articole similare
-
Forța - atracția intermoleculară - o enciclopedie mare de petrol și gaze, articol, pagina 1
-
Interacțiunea rolului - o enciclopedie mare de petrol și gaze, articol, pagina 1
Trimiteți-le prietenilor: