Oxidarea sulfurilor cu oxigen în aer este o reacție exotermă ireversibilă:
MeS + 1,5 O2 = MeO + S02.
Atunci când este încălzit în aer sulfurat atinge o anumită temperatură viteza de reacție devine atât de mare încât căldura evoluate nu numai pentru a compensa pierderile de căldură în mediul înconjurător este suficient, dar, de asemenea, pentru a ridica sulfura de temperatura oxidabile, care accelerează reacția de oxidare. Ta este temperatura la care procesul de oxidare poate continua independent fără furnizarea căldurii din exterior, se numește temperatura de aprindere a sulfurii. Această temperatură depinde de tipul de sulfură și mărimea granulatiei, iar disocierea sulfură mai mare, cu o elasticitate mai mare este mai mică decât sulfurile inferioare cu elasticitate scăzută de disociere.
Rata oxidării sulfurii solide prin oxigenul din aer este determinată de condițiile de difuzie a gazelor prin crusta produselor de reacție solide care acoperă sulfura încă nemodificată în porțiunea centrală a boabelor. Reacția curge la limita fazelor solide - sulfura metalică și produsul solid de reacție - al oxidului metalic, prin care difuzează oxigenul în interior și gazul de dioxid de sulf întâlnește acest lucru. Pe măsură ce sulfura se oxidează, viteza de avans a frontului de reacție încetinește, deoarece condițiile de aprovizionare cu oxigen și îndepărtarea dioxidului de sulf printr-o crustă de oxigen de îngroșare treptată se deteriorează. Timpul necesar pentru oxidarea completă a cerealelor de sulfură crește puternic cu mărirea granulelor.
O creștere a temperaturii peste o anumită limită reduce în multe cazuri rata de oxidare dacă, odată cu creșterea temperaturii, are loc condensarea - sinterizarea crustei de oxid, care împiedică difuzia. În oxidarea sulfurii de fier, o creștere a temperaturii peste 900 ° încetinește oxidarea, deoarece peste 900 ° există o compactare puternică a crustei de oxizi de fier.
Oxidarea sulfurilor cu oxigen în aer este reacția principală a proceselor de ardere a materiilor prime sulfură, care are ca scop îndepărtarea parțială sau completă a sulfului sulfurat. În prezent, numai pulberile cu granulație fină sunt supuse prăjirii. Concentratele de flotație sunt suficient de fine pentru oxidarea rapidă; materiale sulfurate compacte, de exemplu, finshteyny, măcinate fin înainte de ardere.
Vechea metodă de calcinare constă în oxidarea cu aer a unui strat de pulbere de 50-100 mm grosime, așezat pe fundul cuptorului. Deoarece numai strat suficient oxidat rapid pe suprafața particulelor, materialul peregrebaetsya mecanism special, realizandu-se astfel retragerea adâncimii stratului de suprafață a particulelor de sulfură de non-oxidante precum și deplasarea materialului din gazele de furnal curent înainte. Arderea pe podea este lentă, echipamentul este greoi și ineficient. Pentru a elimina complet sulful din materia primă, combustibilul trebuie să fie consumat din cauza pierderilor mari de căldură.
Noi metode intensive de calcinare efectuează oxidarea, astfel încât fiecare boabe de materie primă în timpul prăjirii să fie într-un curent de gaze fierbinți care conțin oxigen. Aceasta creează condițiile cele mai favorabile pentru aprovizionarea cu oxigen și îndepărtarea SO2 prin crusta produselor solide de oxidare a granulelor sulfurate, iar procesul curge la viteza maximă.
Când se calcinează în suspensie, concentratul de sulfură uscată este pulverizat cu o duză de aer în cavitatea cuptorului cu pereți calzi.
Când ardere într-un pat fluidizat incandescent gros (500-1000 mm) pulbere ars material de pe vatra cuptorului a fost purjat continuu cu aer printr-o multitudine de găuri mici de 2 mm diametru în vatră. Jeturi de aer, care penetrează stratul de material de copt, creează fluxuri intense de vortex, dând stratului aspectul unui lichid fierbinte. Concentratul proaspăt este alimentat în mod continuu în patul fluidizat, iar produsul calcinat este transferat continuu prin pragul cuptorului, ceea ce limitează înălțimea patului fluidizat.
Metodele intense de ardere cu materii prime bogate în sulf nu necesită combustibil străin și oferă gaze SO2 bogate. O parte semnificativă a produsului în aceste condiții de ardere este îndepărtată de gaze sub formă de praf, pentru captarea cărora ar trebui utilizate sisteme de colectare a prafului cu randament ridicat.
Exploatarea materialelor cu sulfuri se face cu exces de aer, astfel încât produsul de ardere gazos conține, împreună cu SO2 și N2, o cantitate semnificativă de oxigen. Oxigenul oxidează SO2 la anhidrida sulfurică prin reacția SO2 + 1 / 2O2 = SO3. Această reacție este baza pentru obținerea acidului sulfuric prin metoda de contact. Constanta de echilibru a reacției de disociere a anhidridei sulfuroase
cu precizie foarte mare.
Valorile numerice ale KSO2 sunt prezentate mai jos:
Valorile KSO2 reduse indică o rezistență scăzută a SO3 la temperaturi ridicate. Conform regulii lui Le Chatelier, disocierea SO3 crește odată cu scăderea presiunii. Acest lucru este foarte important pentru procesul de ardere, în care presiunile parțiale ale S03 în gazele de cuptor nu depășesc 0,1 ° C.
Reacția de sinteză a SO3 este puternic inhibată la temperaturi scăzute. Catalizatorul de platină în producerea acidului sulfuric determină formarea de SO3 la 400 ° C, acțiunea catalitică a Fe2O3 este eficientă la 600 ° C.
Compoziția gazelor de furnal în timpul arderii de sinteriz se modifică odată cu schimbarea de temperatură datorată formării și descompunerii SO3. Dacă gazul în vârful formațiunii a avut SO3 SO2 și O2 presiuni parțiale respectiv PSO3 și pO2, apoi datorită formării de SO3 cu SO2 PSO3 presiune și O2 scăderea presiunii parțiale. Ele devin egale cu pSO2 = PS03 - pS03. și pO2 = PO2 - 1 / 2pS03, deoarece SO2 mol și jumătate mol de O2 sunt consumate per mol de S03. Pentru un sistem de echilibru SO2 presiune, SO3 și O2 sunt legate de expresia KSO3, care permite să se calculeze presiunea gazului SO3 în cuptor (pSO3) PG ca o soluție a următoarei ecuații cu respect pSO3.
Prezența S03 în gazele de calcinare determină formarea de sulfați din oxizi de metal în timpul prăjirii sulfurilor.
Sulfații formați sunt suficient de stabili într-o atmosferă de oxidare și pot trece la ciurul final. În unele cazuri, acest lucru este nedorit, în cazul în care scopul arderii este îndepărtarea completă a sulfului, în alte cazuri - în timpul tragerii pentru tratamentul hidrometalurgic ulterior - este utilă formarea de sulfați. Problema condițiilor de formare și descompunere a sulfatului în timpul arderii poate fi rezolvată dacă există caracteristici termodinamice ale sulfatilor.
Caracteristica sulfatului poate fi valoarea (# 916; Z0T) a sulfatului din oxidul metalic și anhidrida sulfurică prin reacția
(Oxid) cond + (SO3) gaz = (sulfat) cond,
atribuită unei cantități de SO3 consumată.
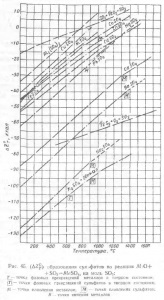
În Fig. 45 sunt grafice ale dependenței de temperatură a imaginii (# 916; Z0T), pentru diferiți sulfați împreună cu curbele (# 916; Z0T), imaginea S03 și S02 pe 1 mol de produs de reacție.
Ecuația reacției de formare a sulfatului determină forma expresiei pentru constanta de echilibru a reacției de disociere a sulfatului Xylf. = valoarea pSO2 (# 916; Z0T) sulph este valoarea numerică a acestei constante:
Valorile (# 916; Z0T) de sulfură și xylf caracterizează rezistența legăturii chimice a oxidului cu SO3 - puterea sulfatului. Cu cât valoarea acestor cantități este mai mare, cu atât mai mică este concentrația sulfatului.
Având în vedere graficele (figura 45), se poate observa că rezistența sulfatului crește odată cu creșterea proprietăților de bază ale oxidului care formează sulfatul. Sulfații mai stabilă formă, oxizi de metale alcaline, sulfați, oxizi sunt mai puțin puternici de calciu și bariu sulfatii sunt încă metale grele bivalent mai puțin durabile și sulfați cele mai instabile formate Al2Oz oxizi amfoteri, Fe2O3.
Având caracteristicile sulfatului și compoziția gazelor de furnal, este posibil să se rezolve problema posibilității sau imposibilității formării sulfatului în același mod în care disocierea compusului este rezolvată în prezența produselor de disociere. Formarea sulfatului este posibilă dacă presiunea produsului gazos de disociere a sulfatului de SO3 în atmosfera gazelor de furnal peste oxid este mai mare sau egală cu presiunea de S03, care se dezvoltă după disocierea sulfatului.
Sulfatul se formează dacă (pSO3) n> (pSO3) sulfură, altfel formarea sulfatului este imposibilă, iar sulfatul deja format trebuie să se descompună.
Practica de prăjire a stabilit că formarea sulfatului este favorizată de un conținut ridicat de SO2 în produsele de prăjire și temperaturi scăzute. Formarea sulfatului în timpul prăjirii este observată la temperaturi de 500-650 °.
La calcinare, formarea de sulfat nu poate fi evitată, deoarece într-un anumit stadiu al condițiilor de ardere există favorizarea sulfatizării. Dacă sulful nu trebuie să rămână în produsul de ardere, sulfații formați anterior trebuie să fie distruși de o creștere a temperaturii. Dacă temperatura crește pe parcursul prăjirii într-o asemenea măsură încât (pSO3) ng devine sulfură mai mică (pS03), formarea ulterioară a sulfatului încetează, iar sulfatul deja format se descompune lent cu eliberarea de S03. Pentru distrugerea rapidă și completă a sulfatului, este necesară creșterea temperaturii, astfel încât presiunea produselor gazoase de disociere a sulfatului să depășească presiunea externă.
Disocierea sulfatului în oxid și SO3 este însoțită de o disociere semnificativă a SO3 în SO2 și oxigen, iar procesul de disociere este descris prin următoarea ecuație de reacție:
iar presiunea produselor de reacție este compusă din presiunile de S03, S02 și O2:
Valoarea Xsulf = pSO3 dă numai una din componentele lui Psulph - presiunea S03. La temperaturi de descompunere apreciabile a sulfatilor puternici, pS03 este doar o presiune totala scurta a produselor de reactie, deoarece S03 este puternic disociat in SO2 si O2.
produse de disociere presiune sulfat SO3, SO2 și O2 sunt interconectate expresie KSO3 și SO2 și presiune O2 - raportul PO2 = 1 / 2pSO2, deoarece aceste gaze sunt oprite descompunerea SO3. Cu cantități Ksulf KSO3 și pentru o anumită temperatură și folosind relațiile de mai sus între cantitățile pSO3, PSO2 și pO2, se poate calcula amplitudinea totală a presiunii gazului în disocierea sulfatului formula
Temperatura la care Psulf ajunge la o valoare de 1 atm este numită temperatura de descompunere a sulfatului. Încălzirea produsului de ardere - ciment la această temperatură asigură descompunerea rapidă și completă a sulfatului format anterior.
Valoarea lui Psulph este ușor determinată experimental prin măsurarea directă a presiunii produselor de disociere a sulfatului. În ceea ce privește valoarea lui Psulph și valoarea lui KSO3, este posibil să se calculeze presiunile parțiale ale SO3, SO2 și O2, adică să se găsească din datele experimentale constanta de disociere a sulfatului de sulf. Pentru multe sulfați există date experimentale privind dependența de temperatură a valorii Psulph.
Temperatura de descompunere a sulfatului este mult mai scăzută decât temperatura la care pS03 la disocierea sulfatului atinge 1 la. Pe graficele (vezi figura 45) valoarea pSO3 = 1 la corespunde cu temperatura la care (# 916; Z0T) imaginea sulfat este zero. De exemplu, (# 916; Z0T) imaginea CdS04 este zero la 1440 ° și -PCdS04 = 1 la 1060 °; (# 916; Z0T), imaginea NiSO4 este zero la 1050 ° și PNiS04 = 1 la 890 °. Prin urmare, necesitatea de a lua în considerare disocierea S03 în calcularea comportamentului sulfatului; nerespectarea acestei condiții conduce la erori mari în determinarea temperaturii de descompunere a sulfatului, cu atât mai mare este rezistența sulfatului.
Temperatura de descompunere a sulfatului este redusă dacă sulfatul se descompune în prezența unui oxid acid volatil, care dă o legătură puternică cu oxidarea sulfatului metalic. De exemplu, în prezența acidului silicic, sulfatul de calciu se descompune în funcție de reacție
CaS04 + Si02 = CaSi03 + S03.
În aceste condiții (# 916; Z0T) Reacțiile CaSO4 de descompunere care implică mai puțin ZSiO2 (# 916; Z0T) CaSO4 reacție de descompunere, fără participarea SiO2 cu o valoare CaSiOs (D2 °) reacție de descompunere în CaO și SiO2. Rezultă că acțiunea ZSiO2 pentru Disociindu SO3 CaSO4 însoțită de o presiune crescută, și, în consecință, temperatura este coborâtă descompunere sulfat.
La descompunerea sulfatilor de oxizi metalici inferiori, care de asemenea formează un oxid superior, reacția de descompunere a sulfatului este complicată prin oxidarea oxidului metalic inferior. De exemplu, reacția de descompunere a 2FeSO4 = Fe2O3 + SO3 + SO2 este însoțită de oxidarea FeO la Fe2O3.
Sulfatul puternic de argint Ag2S04 disociază prin reacția Ag2SO4 = 2Ag + SO3 + 1 / 2O2 cu descompunerea simultană a componentelor de oxid de argint instabil din Ag2O.
În aceste cazuri, valorile reacțiilor (# 916; Z0T) nu coincid cu imaginea sulfatului (# 916; Z0T) și ar trebui calculate prin utilizarea funcțiilor termodinamice care caracterizează noile produse ale procesului.
Desigur, în cazurile descrise de reacții complicate de descompunere a sulfatilor pentru a calcula valoarea Psulph și temperatura de descompunere a sulfatului, este necesar să se ia în considerare disocierea SO3 în SO2 și O2.
Formată între sulfați și sulfuri invariabil posibila reacție laterală oxidarea sulfurii cu sulfați de oxigen, de exemplu, ZnS + 3ZnSO4 = 4ZnO + 4SO2 și formarea de metal cum ar fi PbS + PbSO4 = 2RB + 2SO2.
Când se reduc sulfații cu agenți reducători gazoși și solizi, se pot obține diferite produse în funcție de tipul de sulfat și de temperatură. Sulfații puternici Na2SO4, CaSO4, BaS04 rețin sulful în recuperare lentă, transformându-se în sulfuri prin reacția CaS04 + 4CO = CaS + 4CO.
Descompunerea compușilor chimici cu îndepărtarea completă a componentelor volatile este sarcina unuia dintre tipurile de proces de calcinare calcinare, care este utilizat pentru CaO de calcar, MgO din magnezit, Al2O3 alumină de hidroxid de aluminiu și așa mai departe. N. In cuptoarele pentru calcinarea materialul este încălzit la o temperatură de descompunere rapidă compușii corespunzători: carbonați, hidrați, apoi produsul de calcinare este răcit.
Compuși de degradare (carbonat de hidrat) într-un curent de gaze de furnal este posibilă, dacă presiunea compusului produs gazos de disociere (CO2, H2O) devine mai mare decât presiunea parțială a aceluiași produs în gazele de furnal. Cu toate acestea, până ce presiunea rămâne disocierea produsului compus mai mică decât presiunea totală a atmosfera din cuptor, rata de disociere este scăzută și depinde de condițiile de difuzie a produselor de disociere în atmosferă a gazelor de cuptor. Atunci când este încălzit la o temperatură la care presiunea produselor de disociere gazoase este egală sau mai mare decât presiunea atmosferei cuptor, viteza de proces nu depinde de difuzia factori și este determinată numai de viteza de intrare a căldurii necesare pentru disocierea endotermă a compusului.
Temperatura la care presiunea produselor gazoase de disociere a compusului ajunge la 1 atm este numită temperatura de descompunere a compusului. Spre deosebire de sulfați, produsul de disociere a carbonaților și hidraților constă, în esență, numai din CO2 sau din H2O, deoarece acești compuși puternici nu disociază apreciabil în constituenții lor la temperaturi de calcinare.
În practică, arderea prin calcinare se efectuează în cuptoare cu arbore și reflector, adică sub presiune atmosferică. Temperatura de calcinare trebuie să fie mai mare decât temperatura de descompunere a compusului, carbonatului sau hidroxidului corespunzător.
În această condiție de calcinare, poate fi supus unui material cu durată mare. Durata procesului trebuie să fie suficientă pentru a încălzi întreaga masă a piesei la temperatura de descompunere a compușilor corespunzători.
Articole similare
Trimiteți-le prietenilor: