PROCESELE CATALITICE ÎN SINTEZA CLOROGENĂ (Partea II)
Procedee de clorurare oxidativă
Sunt luate în considerare procesele catalitice de clorurare oxidativă a hidrocarburilor limitative și nesaturate C1-C3, care sunt direcția principală a utilizării de acid clorhidric și determină echilibrul de clor. Se analizează regularitățile cinetice și tehnologice ale proceselor de obținere a clorometanilor, dicloretanului și clorurii de vinil, clorura de alil. Sunt luate în considerare modalitățile de prelucrare calificată a deșeurilor organice cu clor prin metoda hidrogenării și oxiclorării, care asigură utilizarea completă a materiilor prime de hidrocarburi.

Schema I. Conjugarea reacției de oxidare cu acid clorhidric
cu reacția de substituire a clorinării hidrocarburilor saturate:
Schema II. Se potrivesc reacțiile (1) și (2) din schema I cu reacția de dehidroclorurare a derivaților clorurați limitați ai hidrocarburilor.
Schema III. Reacția oxiclorurii de legătură a hidrocarburilor nesaturate.
Schema IV. Reacția oxiclorurii de substituție a hidrocarburilor nesaturate.
Având în vedere, de asemenea, reacțiile secundare de oxidare profundă a mono- și dioxid de carbon, se poate concluziona că oxiclorurarea hidrocarburilor este condiții complexe de proces multipath care ar trebui să fie selectate în funcție de sarcină.
Baza pentru procesul de oxichlorurare a fost reacția de oxidare în fază gazoasă a acidului clorhidric, descoperită de Deacon în 1868.
Oxidarea acidului clorhidric la clor este o reacție reversibilă, care de obicei are loc la o temperatură de aproximativ 400 ° C. Dependența constantei de echilibru asupra temperaturii are forma [4]:
Valorile Kp și ratele de conversie ale HCl și O2 scad considerabil cu creșterea temperaturii procesului. Creșterea excesului de oxigen, iar creșterea presiunii conduce la o creștere a gradului de conversie a conținutului HCI și Cl2 în amestecul de reacție, dar temperaturi în intervalul de 600-700K, atunci când viteza de proces este suficient de mare, conversia de echilibru HCl ajunge la 90%.
Când reacțiile combinate Deacon flux (1) și clorinare (2) (2 1), echilibrul de reacție se schimbă datorită consumului de clor, prin care pot fi aproape conversia completă a HCI. Din acest motiv, toate reacția de oxiclorurare a alcani, alchene și lor clorurate practic ireversibil în domeniul de funcționare al temperaturilor [5].
În general, este un punct de vedere acceptat, potrivit căruia într-o oxidare cu temperatură ridicată și HCI oxiclorurare catalitica componente active este de obicei un amestec de clorură de cupru și pământuri alcaline sunt pe suprafața purtătorului în stare topită. Apariția în clorură cuproasă, ca și în introducerea de cloruri de metale alcaline, conduce la o scădere a eutectice de topire utilizat catalizatori.
Pe baza rezultatelor studiilor cinetice și de adsorbție, a fost propusă o schemă generală a reacției diaconului în prezența catalizatorilor cloromatici [3, 6, 7]:
Această schemă corespunde următoarei ecuații cinetice:
unde K este constanta de echilibru a disocierii termice a clorurii de cupru;
k este constanta vitezei de adsorbție a oxigenului.
Datele obținute au fost utilizate pentru studierea regularităților de clorurare oxidativă a hidrocarburilor saturate - metan și etan.
Oxidarea HCl în prezența metanului se realizează în conformitate cu legile cinetice stabilite pentru procesul diaconului, adică indiferent de prezența clorometanilor în amestecul de reacție. O altă trăsătură revelată a fost caracterul general al regularităților cinetice de formare a clorometanilor în reacțiile de oxichlorurare și clorurare directă în prezența sistemului CuCl2-KCI. Ambele reacții sunt caracterizate de prima ordine cinetică în metan, fracționată în termeni de clor și valori practic identice ale energiei de activare (113 kJ / mol). Ratele de oxichlorurare și clorinare pot fi descrise printr-o ecuație de putere-lege, unde ordinea oxigenului variază de la 0 la 0,25 [3, 8, 9].
Oxidarea este HCI în întregul volum al topiturii pe catalizator, în timp ce reacția de clorurare a metanului și clormetan, precum și oxidarea acestora - pe suprafața topiturii. În plus, aceste reacții au loc în diferite locuri active, iar prezența unui cation de metal tranzițional în centrele în care are loc clorurarea nu este necesară. reacția clorurarea metanului la 425 0 C are loc predominant prin mecanism eterogen, în timp ce la temperaturi mai ridicate pot fi predominante mecanism omogen de terminare a lanțului eterogenă pătratice cu clor.
Proiectarea tehnologică a procesului de oxichlorurare a metanului poate fi diferită, utilizând un pat de catalizator fluidizat sau fix. O combinație a ambelor variante este posibilă, asigurând o disipare eficientă a căldurii și un grad ridicat de conversie a reactivilor inițiali.
Anumite perspective reprezintă posibilitatea realizării industriale a procesului de oxiclorurare a etanului cu producerea directă a produsului dorit - clorură de vinil. Vârful de cercetare în această direcție a venit în 70-lea - 80-lea ani ai secolului al XX-lea și a fost încărcată cu un cost redus semnificativ de gaze naturale în comparație cu prețurile anormal de ridicate ale petrolului de materii prime în cursul perioadei.
Atât din punct de vedere științific cât și din punct de vedere aplicat, interesul este un proces catalitic eterogen, în fază gazoasă, de oxiclorurare a etanului. Procesul are loc în prezența catalizatorilor tradiționali ai diacronului - clorură de cupru cu aditivi pe un purtător inert. În funcție de condițiile procesului, este posibil să se formeze o gamă largă de derivați de clor din etan și etilenă. Pentru formarea preferențială a clorurii de vinii, se preferă temperaturi ridicate de 400-550 ° C.
La fel ca în oxiclorurarea metan, formarea clorului și procesele ulterioare de clorinare apar la diferite situsuri active. Oxiclorurarea derivaților etan și clor din seria etan-etilenă este un complex procedeu proces eterogen omogen printr-o serie de etape paralele secvențiale ale dehidroclorurarea clorurare, și este urmată de reacții de declorurare de oxidare profundă a materiilor prime și intermediarii. Schema generală a conversiilor de etan este următoarea [10]:
omogen, heterogen, eterogen
omogenă ↓ ↑ omogenă
Când procesul se desfășoară la o temperatură de 500-550 ° C, principalele produse sunt clorura de vinil și etilenă, al căror randament total atinge 80% [11]. Rata pierderii de etan nu depinde de presiunea parțială a HCl și este bine descrisă de următoarea ecuație [12]:
Rata de descreștere a derivaților de clor ai metanului, cu excepția 1,1-dicloretanului, este similară cu regularitățile.
În timpul procesului de oxiclorurare a etanului, există, de asemenea, reacții secundare de oxidare a hidrocarburilor și a cloro-lor substituiți pentru a forma oxizi de carbon. Rata reacțiilor de oxidare este descrisă de ecuația:
Principala contribuție la viteza de formare a produselor de oxidare profundă se face prin compuși nesaturați [13]; în timp ce introducerea unui atom de clor în moleculă în mod dramatic (cu un factor de 7-8) crește rata de oxidare. O creștere suplimentară a numărului de atomi de clor reduce randamentul produselor COx: tri- și tetracloretenele practic nu sunt oxidate în condițiile procesului. Parametrii tehnologici cei mai buni au fost obținuți atunci când s-au folosit catalizatori CuCI2-KCI / purtător, a căror suprafață specifică nu trebuie să depășească 10 m 2 / g. Selectivitatea procesului de clorură de vinil este de 35-40% cu gradul de conversie a etanului
95% [14]. La astfel de valori de conversie a reactivilor și în prezența vaporilor de apă (unul dintre produsele procesului), apar conversii secundare: reducerea clorurii de vinil la etilenă și a acetilenului până la monoxidul de carbon.
În ciuda dezvoltării științifice și tehnologice profunde, procesele de oxichlorurare a metanului și etanului în condițiile industriale nu au fost încă realizate.
Motivul pentru aceasta este investiția de capital ridicată, combinată cu o scădere a cererii de clorometani (eliberarea tetraclorurii de carbon este, în general, interzisă de Protocolul de la Montreal din 1987). Transformarea directă a etanului în clorura de vinil este însoțită de formarea bómai mult deșeu decât procesul "etilen". Un anumit rol este jucat de asemeneaóDisponibilitatea mai mare a materiilor prime pentru producerea de etilenă (benzină, motorină) în raport cu țările europene.
Dintre procesele de clorurare oxidativă, cea mai importantă este clorurarea oxidativă a etilenei pentru a produce 1,2-dicloretan ca etapă-cheie a unei scheme echilibrate pentru producerea clorurii de vinil. Clorurarea oxidativă a etilenei se efectuează pe catalizatori care conțin CuCI2. la temperaturi semnificativ mai scăzute (200-3000С) decât procesele diaconului sau oxiclorurarea hidrocarburilor saturate și nu include etapa de oxidare a HCI. Mecanismul de oxichlorurare implică stadiul interacțiunii etilenei cu CuCl2. ca urmare a formării unei forme reduse de cupru:
CI CI CI CI CI CI CI ClC2 H4 / / / / Cu Cu Cu Cu (1a) (1) - Al - O - Al - O - Al - + C2 H4 ® - Al - O - Al - O - Al - ® | | | | | | | | | | | Cl Cl | | | Cu Cu (1c) ® - Al - O - Al - O - Al - + C2 H4 Cl2 (1) | | | | | Cl Cl ClO | | / / (I) Cu Cu Cu Cu (1c), (2a) - Al - O - Al - O - Al - + ½ O2 ® - Al - O - Al - O - Al - (2) | | | | | | | | | | | CI O Cl Cl Cl Cl Cl / / / / Cu Cu Cu Cu (2a) (1a) - Al - O - Al - O - Al - + 2HCl ® - Al - O - Al - O - Al - + H2O ( 3) | | | | | | | | | | |
Alături de cupru în catalizatorii oxiclorurarea etilenei poate fi introdusă ca promotori sau stabilizatori, cloruri metalice, cum ar fi lantan, magneziu, potasiu, și altele. Asta pe de o parte, mărește capacitatea cationii de cupru la coordonarea legării cu olefine, pe de altă parte, se poate reduce proporția de reacții adverse, în special reacții de oxidare profundă [15, p.79].
Produsele secundare în timpul oxiclorinării etilenei pot fi împărțite condiționat în două grupuri:
1. Produsele clororganice adverse, care includ majoritatea hidrocarburilor C1-C2 substituite cu clor, atât din seria de parafine, cât și din cele olefinice;
2. Produse de oxidare profundă - CO și CO2.
Având în vedere faptul că oxizii de carbon reprezintă până la 70% din etilenă transformată în produse secundare, studiul condițiilor de formare a acestora este o problemă importantă aplicată. Este arătat [23] că rata de formare a produselor COx este descrisă printr-o ecuație de tipul:
unde i este etilenă sau dicloretan și viteza de oxidare a dicloretanului este de aproximativ două ori mai mare decât cea a oxidării etilenei.
Oxidarea si diclorura de etilena are loc cea mai mare parte la centrele active, care conțin faze CuCl2 și Cu2 (OH) 3 CI, exces față de interacțiunea cu purtătorul [24,25]. Luând forme active de cupru ca situsuri active reacții de oxidare profunde, se crede că în reoxidarea cupru schema (I) sub formă de reacție (2) legat la un purtător coordinatively, oxidează substratul organic. Reacția de oxidare concurează cu reacția (1) din schema de mai sus, ceea ce explică rolul inhibitor al HCI în reacțiile de oxidare.
Schema generală de formare a oxizilor de carbon în procedeu este după cum urmează
[23]: C 2 H 4 → CH 2 CICH 2 CI → CH 2CICHO → CCl 3 CHO I II III CO ↓ C02
Raportul dintre ratele rutelor de producție ale produselor COx r1. R2. r3 = 1: 2: 0,3
Datele obținute prin studierea structurii catalizatorilor și a efectului său asupra parametrilor cinetici și tehnologici au fost folosiți în dezvoltarea procesului industrial de oxichlorurare a etilenei.
Toate procesele de oxiclorurare a etilenei pot fi împărțite în două caracteristici principale: utilizarea oxigenului în aer sau a oxigenului pur și utilizarea unui pat de catalizator fierbinte sau fix. Tabelul 1 prezintă caracteristicile celor mai importante procese industriale de oxichlorurare.
Tabelul 1. Caracteristicile proceselor industriale de oxichlorurare.
Rata de formare a clorurii de alil poate fi reprezentată prin ecuația:
Catalizatorii joacă, de asemenea, un rol important în punerea în aplicare a principiului proceselor echilibrate pentru materiile prime de hidrocarburi. Cea mai promițătoare este de a furniza industriale procese oxiclorinare nepolari C2 - C3 pentru a da tri- și percloretilena și hidrogenarea selectivă a acestora pentru obținerea de etilenă și propilenă, respectiv, și revenirea lor în ciclul de producție.
Oxigenarea derivaților de clor C2-C3 se efectuează în prezența unui amestec de cloruri de cupru și potasiu depus pe un purtător poros. De preferință, utilizarea purtătorilor cu suprafață specifică redusă (10-15 m2 / g), pentru a reduce formarea de produse secundare de oxidare profunde [30,31]. Aceasta a constatat că, la temperaturi de peste 350 0C, media curge în reacția de oxidare a cuprului acid clorhidric la clor și ultima parte în transformările ulterioare. Rata de oxichlorurare a 1,2-dicloretanului este descrisă de ecuația (similară cu cea adoptată pentru oxiclorurarea alchenelor [32]):
:
Astfel, se obține un proces echilibrat pentru materia primă de hidrocarburi.
Metoda de hidrogenare poate fi, de asemenea, utilizată în prelucrarea tetraclorurii de carbon, a cărei eliberare este interzisă de Protocolul de la Montreal din 1987. în cloroform: CCl4 + H2 → CHCI3 + HCI
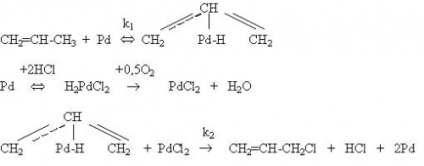
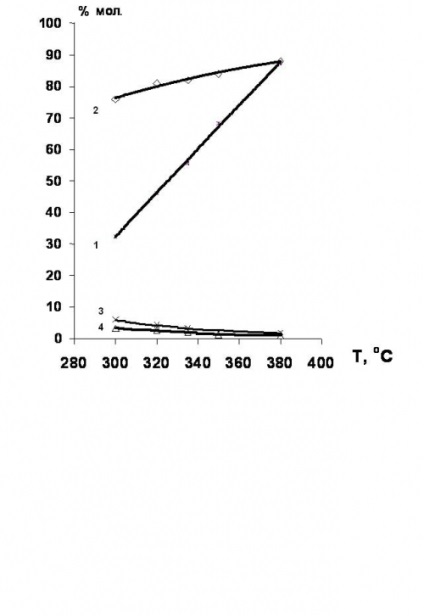
S-a stabilit [34, 35] că hidrodeclorurarea derivaților de clor din seria etan-etilenă se desfășoară în mod avantajos în prezența catalizatorilor care conțin nichel. Randamentul de etilenă în acest caz atinge 80% (figura 4).
Catalizatorii de paladiu sunt mai activi, dar mai puțin selectivă decât nichelul: produsul principal în acest caz este etan, a cărui ieșire ajunge la 70%, iar randamentul de etilenă nu depășește 10-15%.
Așa cum am arătat [34], hidrodeclorurarea se desfășoară în principal printr-un mecanism care implică separarea multiplet a atomilor de clor din molecula compusului inițial. Rata de reacție a hidrodeclorinării este exprimată prin următoarea ecuație:
În acest caz, reactivitatea cloro-olefinelor este mai scăzută în comparație cu cloralcani [35].
În condiții industriale, procesul ar trebui să fie realizat într-un pat de catalizator staționar folosind un reactor tubular. Temperatura este de 320-370 ° C, timpul de contact este de 5-10 s, raportul molar dintre hidrogen pe un atom de clor este de 0,5: 1.
Catalizatorul dezvoltat pentru acest proces este foarte stabil.
Pentru prelucrarea deșeurilor secundare, cum ar fi hexaclorbenzen, hexacloretan etc., se recomandă utilizarea catalizatorilor de paladiu. Produsele organice deshidratate sunt îndreptate în continuare spre ardere, iar acidul clorhidric poate fi eliminat în proces.
Concluzia.
Importanța industrială a proceselor de sinteză organochlorină va crește în viitor. Acest lucru se datorează necesității unei utilizări tot mai largi și mai cuprinzătoare a materiilor prime minerale și organice, care, în acest caz, includ produsele rafinate din sare, petrol și gaz natural. O condiție necesară pentru aceasta este un impact minim asupra mediului. Punerea în aplicare a acestui principiu ar trebui să se realizeze în cel puțin două moduri:
1. Crearea de procese complet echilibrate cu materii prime clor și hidrocarburi;
2. Disponibilitatea unei tehnologii calificate, sigure pentru mediu pentru prelucrarea deșeurilor și a consumului de produse organoclorurate.
Fig.1. Dependența constantei de rată a reacției la magnitudinea lui # 61508; conexiunea H M-CI.
_____ date experimentale
------- datele calculate
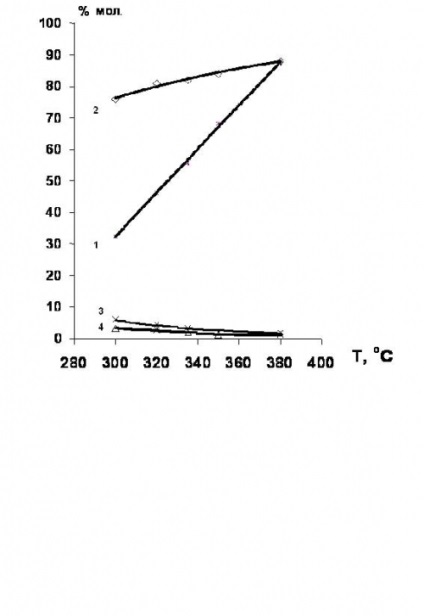
Fig.2. Schema tehnologică a procesului de oxiclorurare a etilenei într-un pat fluidizat al unui catalizator
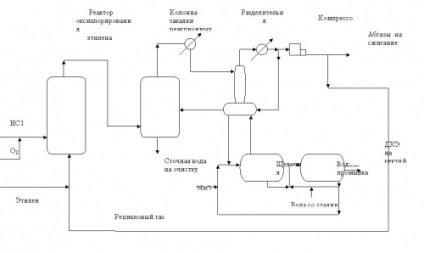
Figura 3. Schema tehnologică a procesului de oxiclorurare a etilenei într-un pat de catalizator fix.
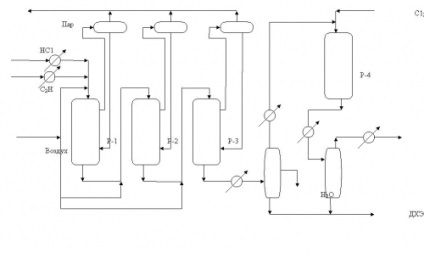
Figura 4. Dependența de temperatură a conversiei 1,2-dicloretanului și selectivitatea formării produșilor de hidroclorurare în prezența catalizatorilor cu conținut de Ni.
1 - conversia 1,2-dicloretanului;
selectivitatea educației: 2 - etilenă; 3 - etan; 4-etil clorură
Trimiteți-le prietenilor: