Pentru purificarea apelor uzate din diferite impurități solubile și dispersate, se utilizează oxidarea anodică și reducerea catodică, electrocoagularea, electroflocularea și electrodializa. Toate aceste procese au loc pe electrozii când un curent electric constant trece prin apele reziduale (Figura 11.8).
Metodele electrochimice fac posibilă extragerea produselor valoroase din apele uzate cu o schemă tehnologică relativ simplă de purificare fără utilizarea reactivilor chimici. Principalul dezavantaj al acestor metode este consumul mare de energie electrică. Tratarea apelor uzate prin metode electrochimice poate fi efectuată periodic sau continuu.
Când canalizarea trece prin spațiul interelectrode al celulei, apar electroliza apei, polarizarea particulelor, electroforeza, procesele de oxidare-reducere, interacțiunea produselor de electroliză între ele.
Oxidarea anodică și reducerea catodică. În electrolizor (vezi figura 11.8) pe ionii electrozi-anodici pozitivi se formează electroni, adică reacționează oxidarea electrochimică; Atașarea electronilor are loc pe catodul electrod-negativ; reacția de reducere continuă.
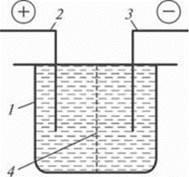
Aceste procese sunt concepute pentru tratarea apelor reziduale provenite din impurități dizolvate (cianuri, amine, alcooli, aldehide, compuși nitro, sulfuri, mercaptani). În procesele de oxidare electrochimică, substanțele din apele reziduale se descompun complet pentru a forma CO2, NH3 și apă sau se formează mai multe substanțe simple și netoxice care pot fi îndepărtate prin alte metode.
Materialele insolubile electrochimice sunt utilizate ca anozi: grafit, magnetit, dioxid de plumb, mangan și ruteniu, care se aplică pe bază de titan.
Catodii sunt fabricați din molibden, un aliaj de tungsten cu fier sau nichel, din grafit, oțel inoxidabil și alte metale acoperite cu molibden, tungsten sau aliajele lor. Procesul se desfășoară în electrolize cu și fără diafragmă.
În plus față de principalele procese de electro-oxidare și reducere, electrofiltarea, electroforeza și electrocoagularea pot să apară simultan.
Eficiența metodelor electrochimice este estimată prin densitatea curentului, tensiunea, coeficientul de utilizare utilă a tensiunii, puterea de ieșire, puterea de ieșire.
Densitatea curentului este raportul dintre curent și suprafața electrodului (A / m 2 A / cm 2).
Tensiunea celulei este constituită din diferența dintre potențialele electrodului și căderea de tensiune în soluție:
unde ea și ek sunt potențialele de echilibru ale anodului și catodului; # 916; ea și - magnitudinea polarizării anodice și catodice; # 916; Uel și Udi - cădere de tensiune în electrolit și diafragmă.
Căderea de tensiune în electrolit (apa uzată) în absența bulelor de gaz este determinată de legea lui Ohm: (11.42) unde i este densitatea curentului din apele reziduale. A / cm2; # 961; - rezistivitate, Ohm · cm; # 948; - distanța dintre electrozii,
Odată cu separarea bulelor de gaz datorită alungirii fluxului dintre electrozii Uel crește. atitudine # 951; de exemplu = (ea - ek) / U se numește coeficientul de utilizare utilă a tensiunii.
Producția curentă este raportul dintre cantitatea de energie electrică necesară teoretic și cea practic consumată, exprimată în fracțiuni ale unei unități sau în procente.
Electrofloatația este o metodă fizico-chimică de purificare a apei de la substanțe insolubile (dispersate). Metoda se bazează pe efectuarea electrolizei apei pe electrozii insolubili și pe efectul de flotare. În procesul de electroflotare, contaminanții insolubili se ridică la suprafața apei uzate, purtată de microbaloanele plutitoare ale gazelor electrolitice.
Electrofloatarea prin utilizarea de electrozi insolubili este folosită pentru purificarea apelor reziduale de la substanțe insolubile - hidroxizi și fosfați metalici, suspensii, produse petroliere și surfactanți. Pentru a intensifica procesul de electroflotare și a crește gradul de purificare, se efectuează neutralizarea apei uzate alcaline-acid, transferul de ioni de metale grele în compuși greu solubili, adică formarea unei faze dispersate, floculare și / sau coagulare.
5. Conceptul de risc. Risc ca măsură de pericol. Esența noțiunii de "risc acceptabil"
Riscul (R) - caracteristica cantitativă a pericolului, determinată de frecvența implementării pericolelor. Cantitativ, se exprimă prin formula:
unde n este numărul de apariții de pericole;
N este numărul posibil de apariții de pericole.
Articole similare
-
Tratarea apei reziduale din metale grele prin electroliză, curățarea membranelor, metode de sorbție
-
Metode fizico-chimice de tratare a apelor reziduale și tipurile acestora
Trimiteți-le prietenilor: