Înlocuirea atomilor de hidrogen în moleculele de alcani pe orice heteroatom (halogen, azot, sulf, oxigen etc.) sau o grupare determină o redistribuire a densității electronice. Natura acestui fenomen este diferită. Depinde de proprietățile heteroatomului (electronegativitatea acestuia) și de tipul de legături prin care această influență se răspândește.
Dacă influența substituentului este transferată cu participarea s-obligațiunilor, atunci starea electronică a obligațiunilor se schimbă treptat. Această polarizare se numește efectul inductiv (I). este reprezentată de o săgeată în direcția deplasării densității electronice. Efectul inductiv se datorează dorinței atomului sau a grupului de atomi de a se hrăni sau de a atrage pe sine densitatea electronică, în legătură cu care poate fi pozitivă sau negativă. Efectul inductiv negativ arată elementele mai electronegative decât carbonul, adică halogeni, oxigen, azot și altele, precum și grupuri cu o încărcătură pozitivă asupra elementului legat de carbon. Efectul inductiv negativ scade de la dreapta la stânga în perioada și de sus în jos în grupul sistemului periodic:
În cazul substituenților cu încărcătură totală, efectul inductiv negativ crește cu creșterea electronegativității atomului legat la carbon:
În cazul substituenților complexe, efectul inductiv negativ este determinat de natura atomilor care constituie substituentul. În plus, efectul inductiv depinde de natura hibridizării atomilor. Astfel, electronegativitatea atomilor de carbon depinde de hibridizarea orbitalilor electronici:
Efectul inductiv pozitiv se manifestă: elementele mai puțin electronegative decât carbonul, grupurile cu sarcină totală negativă, grupările alchilice. + I - efectul scade în serie:
Efectul inductiv al substituentului se descompune rapid, pe măsură ce crește lungimea lanțului.
substituent Disponibilitate cu o pereche de electroni liber sau p liber orbital atașat sistemului care conține p electroni, ceea ce duce la posibilitatea de amestecare a p-orbitali substituenților (ocupate sau vacante) cu orbitali p și redistribuire a densității de electroni în compușii. Acest efect se numește mezomeric.
Schimbarea densității electronilor este de obicei nesemnificativă, iar lungimea legăturii practic nu se schimbă. Deplasarea nesemnificativă a densității electronice este judecată din momente dipolice, care chiar și în cazul efectelor de cuplare mari la atomii extreme ai sistemului conjugat sunt mici.
Efectul mezomeric este reprezentat de o săgeată curbă îndreptată spre deplasarea densității electronice:
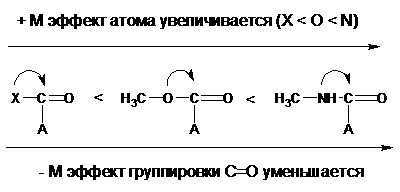
În funcție de direcția de deplasare a norului de electroni, efectul mezomeric poate fi pozitiv (+ M) și negativ (-M). Efectul mezomeric pozitiv scade odată cu creșterea electronegativității atomului purtând o pereche de electroni împărțită în comun, datorită unei scăderi a tendinței de eliberare a acestuia, precum și a unei creșteri a volumului atomului:
Efectul mezomeric pozitiv scade dacă atomul este legat la grupul acceptor de electroni:
Efectul mezomeric negativ crește cu creșterea electronegativității atomului și atinge valorile sale maxime dacă atomul acceptant poartă o încărcătură:
> C = O + H >>> C = O
O scădere a efectului mezomeric negativ este observată atunci când grupul acceptor este conjugat cu grupul donor:
Un efect similar cu mezomericul pozitiv. Apare atunci când o grupare alchil înlocuiește hidrogenul cu o legătură multiplă. Acest efect este îndreptat spre o legătură multiplă și se numește hiperconjugare (supraconjugare):
Superconjugarea scade în secvență:
Tabel rezumativ al substituenților și efectele lor electronice
Substituentul sau grupul de atomi
Articole similare
Trimiteți-le prietenilor: