Efecte electronice - deplasarea densității electronice într-o moleculă, ion sau radical sub influența substituenților.
Orice atom (altul decât hidrogen) sau un grup de atomi legați la un atom de carbon este considerat a fi un substituent.
Există efecte electronice inductive și mezomerice ale substituenților.


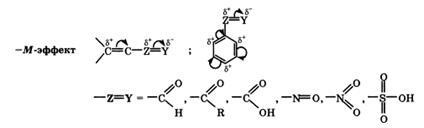
+Efectul M este caracteristic grupurilor -OH și -NH2. Efectul M este expus de substituenți cu atomi electronegativi și înlocuind densitatea electronică prin ea însăși. -M-efect este caracteristic pentru grupurile -CH = O, -COOH, -NO2. Deși aceste grupuri au perechi de electroni neparticipate, aranjamentul spațial al orbitalilor cu acești electroni nu le permite să intre într-un sistem de cuplare. Astfel, în acest caz, substituentul poate trage doar electroni din sistemul comun de cuplare datorită electronegativității sale mai mari.
Aciditatea și bazicitatea compușilor organici.
Pentru a evalua aciditatea și bazicitatea compușilor organici, două teorii sunt cele mai importante: teoria lui Bronsted și teoria lui Lewis.
Conform teoriei lui Lewis, proprietățile acide și bazice ale compușilor sunt determinate de capacitatea lor de a primi sau de a da o pereche de electroni cu formarea unei legături. În conformitate cu principiul LMCO, acizii și bazele Lewis sunt împărțite în greu și moale.
Lewis acizii pot fi atomi, molecule sau cationi care au un orbital vacant și sunt capabili să primească o pereche de electroni cu formarea unei legături covalente.
Lewis acizi sunt acceptori ai unei perechi de electroni; Bazele Lewis sunt donatori de electroni. Bazele Lewis (atom, moleculă sau anion) trebuie să posede cel puțin o pereche de electroni de valență, pe care ei le pot oferi partenerului pentru a forma o legătură covalentă. Toate bazele Lewis sunt reactivi nucleofili.
Conform teoriei lui Bronsted (teoria protolitică), aciditatea și bazicitatea compușilor sunt asociate cu transferul protonului H +. Acidul și baza formează o pereche de acid-bază conjugată în care acidul este mai puternic, cu cât baza este mai slabă și viceversa, cu cât baza este mai puternică, cu atât este mai slab acidul conjugat cu acesta.
Acizii bronzi (acizii protoni) sunt molecule neutre sau ioni capabili să redea un proton (donatori de protoni).
Bazele Bronsted sunt molecule neutre sau ioni capabili să atașeze un proton (acceptor de protoni).
Aciditatea și bazicitatea nu sunt absolute, dar proprietățile relative ale compușilor: proprietățile de acid sunt detectate numai în prezența unei baze; proprietăți de bază - numai în prezența acidului. Apa este de obicei utilizată ca solvent în studiul echilibrului acido-bazic.
În funcție de natura elementului este asociat cu pro-ton distinge acidul OH (acizii carboxilici, fenoli, alcooli), SH-acide (tioli), NH-acide (amine, amide, imide), CH-acide (hidrocarburi și derivatele acestora). Elementul și atomul de hidrogen asociat cu acesta se numesc centrul acid. În toate cazurile, există o deplasare a densității electronice de la atomul de hidrogen la cel mai electronegativ, protonul fiind mai mult sau mai puțin descompus. Elementul electronegativitate mai mare este asociat cu un proton, cu atât mai mare aciditatea compusului (de exemplu, acidul carboxilic este un acid mai puternic decât tioli sau aminele).
Prezența în moleculă a grupurilor de absorbție a electronilor, care au efecte electronice negative, mărește încărcătura pozitivă a protonului, ceea ce duce la o creștere a proprietăților acide.
Pentru a forma o legătură covalentă cu protonul, bazele Bronsted trebuie să furnizeze fie o pereche de electroni nepartizați, fie electroni de legătură p. În concordanță cu aceasta, bazele Bronsted sunt împărțite în n-baze și baze p.
n-bazele pot fi încărcate neutru sau negativ. Ca regulă, anionii au un caracter de bază mai pronunțat decât substanțele neutre. Aceasta este, de exemplu, NH2- sau ionul de hidroxid de ioni amonici HO - depășește în principiu amoniac NH3 și apă H2O.
În baze p, care includ alchene, alcadiene, arene, centrul bazicității, adică locul de atașare a protonului sunt electronii legăturii p. Acestea sunt baze foarte slabe, deoarece perechile de electroni protonate nu sunt libere.
Prezența substituenților donor de electroni crește bazicitatea compușilor organici.
1. Dependența acidității de heteroatom.
Natura unui heteroatom este înțeleasă ca electronegativitatea (EO) și polarizabilitatea sa. Cu cât mai mult (EO) cu atât este mai ușor ruptura heterolitică din moleculă. În perioadele de la stânga la dreapta, cu o creștere a încărcăturii nucleului, crește (EO), adică capacitatea elementelor de a deține o încărcare negativă. Ca rezultat al deplasării densității electronice, legătura dintre atomi este polarizată. Cu cât mai mulți electroni și cu cât raza atomului este mai mare, cu atât electronii din nivelul energiei externe sunt localizați din nucleu, cu atât este mai mare polarizabilitatea și cu atât este mai mare aciditatea.
Exemplu: CH-NH-OH-SH-
creștere în E.O. și aciditate
C, N și O sunt elemente ale aceleiași perioade. EO perioada creste, aciditatea creste. În acest caz, polarizabilitatea nu va afecta aciditatea.
Polarizabilitatea atomilor în perioada variază nesemnificativ, prin urmare factorul principal care determină aciditatea este E.O.
Acum, luați în considerare SH-
O, S - sunt în același grup, raza din grup creste de sus în jos, de unde și polarizabilitatea atomului crește, ceea ce duce la o creștere a acidității. În S, raza atomului este mai mare decât cea a lui O, astfel încât tiolii prezintă proprietăți acide mai puternice decât alcoolii.
2. Efectul radicalului hidrocarbonat și al substituenților prezenți în acesta
Substituenții de electroni (EA) contribuie la delocalizarea densității electronilor, ceea ce conduce la o stabilitate a anionilor și, în consecință, la o creștere a acidității.
Substituenții de donare electronică (ED), dimpotrivă, contribuie la concentrația de densitate electronică în centrul acidului, ceea ce duce la o scădere a acidității și la o creștere a bazicității.
Interacțiunea moleculelor sau a ionilor dintr-o substanță dizolvată cu un solvent se numește procesul de solvație. Stabilitatea anionului depinde în mod semnificativ de soluția sa în soluție: cu cât solul este mai solvat, cu atât este mai stabil și cu cât solvația este mai mare cu atât dimensiunea ionului este mai mică și delocalizarea acestuia este mai mică.
Articole similare
Trimiteți-le prietenilor: